Voriconazol - eine neue Therapieoption bei systemischen Mykosen
Aktuelle Ergänzungen am Ende des Textes
Seit Jahrzehnten gilt Amphotericin B (AMPHOTERICIN B) als die Standardsubstanz zur Therapie systemischer Mykosen, obwohl die Behandlung aufgrund der häufigen toxischen
Reaktionen bekannterweise problematisch ist. Die besser verträgliche liposomale Zubereitung des Arzneimittels (AMBISOME, s. ZCT 1993; 14: 27 - 28) hat sich wegen des extrem hohen Preisniveaus nicht
durchsetzen können. So ist verständlich, dass den neuentwickelten Antimykotika besondere Beachtung zukommt. Vor einigen Monaten wurde Caspofungin
(CASPOFUNGIN) als eine neue Therapieoption bei systemischen Mykosen vorgestellt (ZCT 2002; 23: 3 - 4). Nun steht mit Voriconazol (VFEND) ein weiteres, vielversprechendes, neues Antimykotikum zur
Verfügung. Da sich derzeit weitere Arzneimittel für systemische Pilzinfektionen in der Entwicklung befinden, lässt sich absehen, dass sich die Therapiestandards in den kommenden Jahren wesentlich
ändern werden (1).
Chemische Struktur, Struktur-Wirkungsbeziehungen
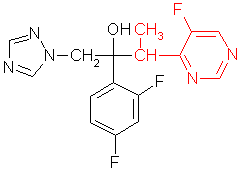
Voriconazol ist ein Antimykotikum aus der Gruppe der Azole; es gehört zu den Triazolen und besitzt eine ähnliche chemische Struktur wie Fluconazol
(DIFLUCAN, ZCT 1990; 11: 36 - 37). Alle Azole, also Imidazole und Triazole, besitzen offenbar den gleichen Wirkungsmechanismus: sie hemmen die Umwandlung von Lanosterol in Ergosterol, einem
essentiellen Bestandteil der Pilzzellmembran. Eine geringe Änderung des Fluconazolmoleküls in Form einer zusätzlichen Methylgruppe bewirkt jedoch bereits eine etwa zehnfach ausgeprägtere Hemmung der
Lanosteroldemethylase aus A. fumigatus. Eine nochmalige Aktivitätssteigerung konnte durch den Ersatz eines Triazolrestes durch einen fluorierten Pyrimidinring erreicht werden. So ergibt sich
schließlich beim Vergleich von Fluconazol und Voriconazol eine Senkung der IC50 (= Konzentration, bei der die Enzymaktivität um 50% gehemmt wird) von 4,8 µM auf 0,053 µM (2).
Wirkungsmechanismus und antimykotische Aktivität
Biochemische Untersuchungen haben ergeben, dass Azolantimykotika das Cytochrom-P450-Enzym Lanosterol-14a-Demethylase (= CYP51A1) inhibieren und dadurch die Abspaltung einer Methylgruppe vom
Kohlenstoffatom 14 des Lanosterols verhindern. Die MHK90-Werte von Voriconazol sind gegenüber einer Vielzahl von Pilzisolaten, darunter pathogene Hefen, Fadenpilze, und dimorphe Pilze, ermittelt
worden. Bei Hefen zeigt Voriconazol nur eine relativ geringe Wirkungssteigerung im Vergleich zu Fluconazol, ein bedeutender Unterschied zwischen den beiden Triazolen besteht jedoch in der fungiziden
Wirkung von Voriconazol gegen Aspergillus-Spezies. In diesen In-vitro-Experimenten wurde trotz der erheblichen Aktivitätssteigerung allerdings die fungizide Aktivität von Amphotericin B nicht ganz
erreicht (3). Erreger mit reduzierter Empfindlichkeit gegen Fluconazol und Itraconazol (SEMPERA u.a.; vgl. ZCT 1991) reagieren gewöhnlich auch gegen
Voriconazol weniger empfindlich.
Pharmakokinetische Eigenschaften
Voriconazol steht zur oralen und parenteralen Therapie zur Verfügung. Die Substanz wird nach oraler Gabe rasch und nahezu vollständig resorbiert; da Nahrungsaufnahme die Resorption beeinflusst,
sollte das Arzneimittel frühestens ein bis zwei Stunden nach einer Mahlzeit eingenommen werden. Bei kontinuierlicher Einnahme von zweimal täglich 200 mg wurden Spitzenspiegel von etwa 2 bis 3 mg/l
gemessen, bei höherer Dosierung steigen die Spiegel überproportional, Voriconazol weist also ein nicht-lineares pharmakokinetisches Verhalten auf (4)
Das Antimykotikum wird durch mehrere hepatische Cytochrom-P450-abhängige Monooxygenasen metabolisiert (CYP2C19, CYP2C9, CYP3A4). Für CYP2C19 sind genetische Polymorphismen bekannt, bei Patienten mit
geringer metabolischer Kapazität können die Plasmakonzentrationen etwa vierfach erhöht sein. Bei hepatischer Insuffizienz (Child-Pugh A und B) ist eine Dosisanpassung notwendig, bei
Niereninsuffizienz kann die Dosierung der Tabletten unverändert bleiben. Eine intravenöse Therapie sollte jedoch bei deutlich eingeschränkter Nierenfunktion nicht erfolgen, da das Vehikel der
Infusionslösung, ein Cyclodextrinderivat, renal eliminiert wird.
Indikationen und Dosierung
Die Zulassung des neuen Antimykotikums zur Therapie von systemischen Infektionen durch Aspergillus und einigen anderen, seltenen Pilzarten, wie Scedosporium- oder Fusarium-Spezies, basiert auf
mehreren umfangreichen klinischen Vergleichstudien. Bei 277 Patienten mit invasiven Aspergillus-Infektionen wurde das Azol mit Amphotericin B verglichen: 12 Wochen nach Beginn der Behandlung hatten
53% der Patienten zufriedenstellend auf Voriconazol angesprochen, jedoch nur 32% in der Vergleichsgruppe; auch der Anteil der überlebenden Patienten war in der Voriconazol-Gruppe deutlich höher als
in der Amphotericin B - Gruppe.5 Bei neutropenischen Patienten mit Fieber erwies sich Voriconazol in einer umfangreichen Vergleichsstudie als ähnlich wirksam wie Amphotericin B (6)
Die Standarddosierung beträgt zweimal täglich 200 mg oral oder zweimal täglich 4 mg/kg als intravenöse Kurzinfusion; am ersten Behandlungstag wird bei beiden Applikationsarten eine höhere Dosis
verabreicht (oral: 400 mg; intravenös: 6 mg/kg), um rasch ausreichende Wirkspiegel zu erhalten.
Unerwünschte Wirkungen und Interaktionen
Bei etwa einem Drittel aller Patienten, die mit Voriconazol behandelt werden, treten vorübergehende Sehstörungen auf. Es kommt zu verschwommenem Sehen, zu Störungen des Farbsehens oder zur
Photophobie, die als alleinige Symptome oder in Kombination auftreten können. Aufgrund der Symptomatik bestehen Risiken beim Autofahren oder dem Bedienen von Maschinen. Der Mechanismus dieser
unerwünschten Wirkung ist unklar, nach den bisherigen Erfahrungen sind die Veränderungen rasch reversibel. Es ist bemerkenswert, dass im Rahmen einer doppelblind durchgeführten Studie zur
Pharmakokinetik und Verträglichkeit auch bei etwa 10% der mit Placebo behandelten Patienten Sehstörungen auftraten, die vom Untersucher als Substanz-bezogen eingeschätzt wurden (4)
Darüber hinaus wurden während der klinischen Prüfung ähnliche unerwünschte Wirkungen beobachtet, wie sie von anderen Azolen bereits bekannt sind: gastrointestinale Störungen, wie Übelkeit und
Erbrechen, Exantheme und Anstieg der Transaminasen. Im direkten Vergleich zu Amphotericin B war vor allem die signifikant bessere renale Verträglichkeit des Voriconazol von Bedeutung.
Frauen im gebärfähigen Alter müssen während der Behandlung wirksame Verhütungsmaßnahmen ergreifen, weil tierexperimentell ein teratogenes Potential von Voriconazol erkannt wurde (7).
Die Elimination von Voriconazol verläuft über hepatische Monooxygenasen, sodass zahlreiche Interaktionen mit anderen Arzneistoffen, die über den gleichen Weg metabolisiert werden, möglich sind. Die
gleichzeitige Gabe von Sirolimus (RAPAMUNE), Terfenadin (TERFENADIN-ratiopharm u.a.), Pimozid (ORAP), Mutterkornalkaloiden und einigen anderen Substanzen ist kontraindiziert, da Voriconazol deren
Plasmaspiegel erhöhen kann. Andererseits können Rifampicin (RIFA u.a.), Carbamazepin (TEGRETAL u.a.) und ähnliche Arzneistoffe mit Induktionspotential zu einer Reduktion der Voriconazol-Spiegel
führen. Eine gleichzeitige Behandlung mit diesen Pharmaka ist somit ebenfalls kontraindiziert. Eine ausführliche Tabelle über mögliche Interaktionen zwischen Azolen und anderen Medikamenten steht auf
unserer Internetseite zur Verfügung.
ZUSAMMENFASSUNG
Voriconazol (VFEND) ist ein neues Azol zur Therapie invasiver Mykosen. Es leitet sich vom Fluconazol (DIFLUCAN) ab, besitzt aber eine deutlich höhere
Aktivität gegen Aspergillus niger. Es wird zweimal täglich oral oder intravenös verabreicht. Im direkten Vergleich mit Amphotericin B (AMPHOTERICIN B) erwies es sich als therapeutisch gleichwertig
oder überlegen. Die Substanz verursacht häufig Sehstörungen, die nach bisheriger Kenntnis nur kurzfristig auftreten und vollständig reversibel sind. Die übrigen unerwünschten Wirkungen und
Interaktionen entsprechen weitgehend denen der anderen Azole. Insbesondere die im Vergleich zu Amphotericin B fehlende Nephrotoxizität ist als wichtiger Vorteil anzusehen.
1. MASCHMEYER
G. New antifungal agents-treatment standards are beginning to grow old. J
Antimicrob Chemother. 2002 Feb;49(2):239-41.
2. CHANDRASEKAR
PH, MANAVATHU E. Voriconazole: A second-generation triazole. Drugs
Today (Barc). 2001 Feb;37(2):135-148.
3. MANAVATHU
EK, CUTRIGHT JL et al. Organism-dependent fungicidal activities of azoles. Antimicrob
Agents Chemother. 1998 Nov;42(11):3018-21.
4. PURKINS
L, WOOD N et al. Pharmacokinetics and safety of voriconazole following intravenous- to oral-dose
escalation regimens. Antimicrob Agents Chemother. 2002;46:2546-53.
5. HERBRECHT
R, DENNING DW et al. Voriconazole versus amphotericin B for primary therapy of invasive
aspergillosis. N Engl J Med. 2002;347:408-15.
6. WALSH
TJ, PAPPAS P et al. Voriconazole compared with liposomal amphotericin B for empirical antifungal
therapy in patients with neutropenia and persistent fever. N
Engl J Med. 2002;346:225-34.
7. Fachinformation VFEND Pfizer GmbH, Karlsruhe; 2002
Ergänzungen (Dezember 2009)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 5, 2002) sind zahlreiche weitere Arbeiten über Voriconazol publiziert worden. Insbesondere soll
an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
FLUCKINGER U, MARCHETTI O et
al. Treatment options of
invasive fungal infections in adults. Swiss Med Wkly.
2006;136(29-30):447-63.
THEURETZBACHER U, IHLE F et
al.
Pharmacokinetic/pharmacodynamic profile
of voriconazole.
Clin Pharmacokinet.
2006;45(7):649-63.
APERIS G, MYLONAKIS E. Newer
triazole antifungal agents: pharmacology, spectrum, clinical efficacy and limitations. Expert Opin Investig Drugs. 2006 Jun;15(6):579-602.
SHAKERI-NEJAD K, STAHLMANN R.
Drug interactions during therapy with three major groups of antimicrobial agents. Expert Opin Pharmacother. 2006 Apr;7(6):639-51.
KULLBERG BJ, SOBEL JD et al.
Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial.
Lancet. 2005 Oct
22-28;366(9495):1435-42.
KOFLA G, RUHNKE M.
Voriconazole: review of a broad spectrum triazole antifungal agent.
Expert Opin Pharmacother. 2005
Jun;6(7):1215-29.
HERBRECHT R. Voriconazole:
therapeutic review of a new azole antifungal. Expert Rev Anti Infect Ther.
2004;2:485-97.
BOUCHER HW, GROLL AH et al.
Newer systemic antifungal agents : pharmacokinetics, safety and efficacy. Drugs. 2004;64(18):1997-2020.
RUHNKE M. Mucosal and systemic
fungal infections in patients with AIDS: prophylaxis and treatment.
Drugs.
2004;64(11):1163-80.
JOHNSON LB, KAUFFMAN CA. Voriconazole: a new triazole antifungal agent.
Clin Infect Dis 2003; 36: 630-637
PEARSON MM, ROGERS PD et al.Voriconazole: a new triazole antifungal agent. Ann Pharmacother 2003; 37: 420-432
SCOTT LJ, SIMPSON D. Voriconazole : a review of its use in the management of invasive
fungal infections. Drugs. 2007;67(2):269-98.
GOODWIN ML, DREW RH. Antifungal serum concentration
monitoring: an update. J Antimicrob Chemother. 2008 Jan;61(1):17-25.
CAMUSET J, NUNES H et al. Treatment of chronic pulmonary
aspergillosis by voriconazole in nonimmunocompromised patients. Chest. 2007 May;131(5):1435-41.
MELETIADIS J, CHANCOCK S et al. Defining targets for
investigating the pharmacogenomics of adverse drug reactions to antifungal agents. Pharmacogenomics. 2008 May;9(5):561-84.
TAN K, BRAYSHAW N et al. Investigation of the potential relationships between plasma
voriconazole concentrations and visual adverse events or liver function test abnormalities.
J Clin Pharmacol. 2006 Feb;46(2):235-43.
ABEL S, ALLAN R et al. Pharmacokinetics, safety and
tolerance of voriconazole in renally impaired subjects: two prospective, multicentre, open-label, parallel-group voluntee studies. Clin Drug Investig. 2008;28(7):409-20.
HORN DL, NEOFYTOS D et al. Epidemiology and outcomes of
candidemia in 2019 patients: data from the prospective antifungal therapy alliance registry. Clin Infect Dis. 2009 Jun 15;48(12):1695-703.