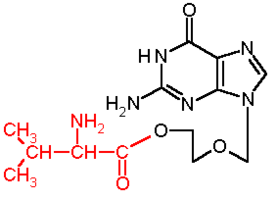
Valaciclovir - Veresterung mit L-Valin bewirkt bessere Bioverfügbarkeit von Aciclovir
Unveränderter Text aus ZCT Heft 1, 1996
Aktuelle Ergänzungen am Ende des Textes
Das Virustatikum Aciclovir (ZOVIRAX u. a.) wird seit mehr als 10 Jahren zur Behandlung von Virusinfektionen eingesetzt (ZCT 1983; 4: 28). Nach
Umwandlung in das entsprechende Triphosphat wird das Nukleosid-Analogon in die DNA eingebaut und es kommt zum Kettenabbruch, da wegen des Fehlens der 3'-Hydroxylgruppe der Nukleinsäurestrang nicht
weiter fortgeführt werden kann. Da die entscheidende primäre Umwandlung in das Aciclovir-Monophosphat bevorzugt in solchen Zellen erfolgt, in denen sich Herpesviren vermehren (viruskodierte Kinase!),
besteht eine ausreichend selektive Wirkung in Herpes-infizierten Zellen.
Strukturformel von Valaciclovir. Rot: Valinrest
Aciclovir ist einerseits ein wirksames und potentiell lebensrettendes Medikament - zum Beispiel, wenn es bei einer Herpes-Enzephalitis intravenös
verabreicht wird oder bei Virusinfektionen von immunsupprimierten Patienten. Andererseits kann nur mit einem sehr begrenzten therapeutischen Erfolg gerechnet werden, wenn das Chemotherapeutikum bei
immunkompetenten Patienten zum Einsatz kommt. Die generelle Anwendung der sehr teuren Substanz bei Patienten ohne Störung des Immunsystems ist nach wie vor umstritten - der therapeutische Erfolg ist
gering und nur nachweisbar, wenn mit der Behandlung sehr frühzeitig begonnen wird.
Mit Auslaufen des Patentschutzes wird Aciclovir seit kurzem auch als Generikum angeboten, was zu einem Rückgang des Preisniveaus für dieses Arzneimittel geführt hat. Vom Hersteller des
Originalpräparates wird nun mit Valaciclovir (VALTREX) ein neu entwickeltes Aciclovir-Derivat zur Therapie des Herpes zoster angeboten. Valaciclovir zeichnet sich durch eine deutlich bessere
Bioverfügbarkeit aus. Dieses "Prodrug" stellt chemisch gesehen einen Ester aus Aciclovir und der Aminosäure L-Valin dar ("Einschleus-Ester"), der rasch durch hepatische Esterasen gespalten wird
(1).
Während nur etwa 10 bis 20% einer oral verabreichten Aciclovir-Dosis aus dem Magen-Darmtrakt resorbiert werden, ist die Bioverfügbarkeit des Esters etwa 3 bis 5 mal höher. Dies geht aus einem
direkten Vergleich von intravenös infundiertem Aciclovir (350 mg) mit oral gegebenem Valaciclovir (1000 mg) bei 12 gesunden Probanden hervor. Während die Spitzenspiegel bei Einnahme des Esters etwa
um ein Viertel niedriger lagen (6,6 ± 2,8 vs. 9,2 ± 1,9 mg/l), waren die AUC-Werte ("Fläche unter der Kurve") für beide Applikationsarten etwa gleich. Es konnte gezeigt werden, daß Valaciclovir rasch
und nahezu vollständig in Aciclovir umgewandelt wird. Die Elimination des Wirkstoffs erfolgte mit einer Halbwertzeit von etwa 2,5 Stunden überwiegend unverändert renal.
Bestätigt werden diese Werte durch die pharmakokinetischen Daten aus einem Doppelblind-Versuch an über 1000 Zosterpatienten ab 50 Jahren: nach Einnahme von 800 mg Aciclovir wurden maximale
Plasmakonzentrationen von im Mittel 2,2 mg/l gemessen (Minimum und Maximum: 1,0 bis 12,6 mg/l); beachtenswert ist die hohe Variabilität der Werte, die sich durch die schlechte Bioverfügbarkeit der
Substanz erklärt. Die mittleren Plasmaspiegel von Aciclovir nach Einnahme von Valaciclovir waren deutlich höher (Bereich: 2,8 bis 16,1 mg/l; Mittelwert: 5,7 mg/l) (2).
Valaciclovir ist bei Herpes zoster ("Gürtelrose") in einer Dosierung von dreimal täglich 1000 mg oral indiziert. Der Anteil von Patienten, bei dem nach sechs Monaten noch Schmerzen bestanden, war im
Vergleich zu einer Behandlung mit Aciclovir geringfügig von 26% auf 19% reduziert. Die Therapie muß jedoch innerhalb von drei Tagen nach Beginn der Symptomatik erfolgen, sonst ist die Behandlung
völlig unwirksam.
In der klinischen Prüfung erwies sich das Arzneimittel als ähnlich gut verträglich wie Aciclovir. Zu den beobachteten unerwünschten Wirkungen gehören gastrointestinale Störungen und ZNS-Reaktionen in
ähnlicher Inzidenz, wie sie unter der Gabe von Placebo beobachtet wurden. Bei eingeschränkter Nierenfunktion (Kreatinin-Clearance 15-30 ml/min) muß die Dosierung von Valaciclovir reduziert werden
(zweimal 1000 mg/Tag). Da bisher zu wenig Erfahrungen bei immunsupprimierten Patienten oder bei Patienten mit gestörter Leberfunktion vorliegen, sollte die Substanz nicht bzw. nur zurückhaltend bei
diesen Patientengruppen eingesetzt werden.
Ausreichende Erfahrungen über die Anwendung in der Schwangerschaft liegen ebenfalls nicht vor. Es gibt mittlerweile Untersuchungen mit einigen Hundert Patientinnen, die Aciclovir im ersten Drittel
der Schwangerschaft eingenommen hatten und die vom Hersteller des Arzneimittels prospektiv erfaßt wurden ("Aciclovir Pregnancy Registry"). Die Daten zeigen, daß offenbar kein teratogenes Risiko unter
diesen Bedingungen besteht (niedrige Dosen von Aciclovir, geringe Plasmakonzentrationen!). Völlig unklar ist derzeit, ob ein Risiko für Fehlbildungen bei der Behandlung mit Valacicloir während der
Schwangerschaft besteht. Die im Plasma erzielten maximalen Spitzenkonzentrationen von Aciclovir von bis zu 16 mg/l (70 µM) erwiesen sich als eindeutig embryotoxisch in Versuchen mit Rattenembryonen3
und die teratogenen Wirkungen von Aciclovir bei dieser Spezies sind mehrfach beschrieben worden (4,5).
ZUSAMMENFASSUNG
Valaciclovir (VALTREX) ist ein Valinester des Aciclovir (ZOVIRAX u. a.). Nach oraler Gabe wird die Aminosäure Valin rasch abgespalten und der Wirkstoff freigesetzt. Die Bioverfügbarkeit des
Virustatikums wird durch die Derivatisierung um etwa das drei- bis fünffache erhöht und die Plasmakonzentrationen sind signifikant höher. In klinischen Studien bei älteren Patienten (> 50 Jahre)
mit Herpes zoster erwies sich das neue Prodrug in einer Dosierung von dreimal 1000 mg als ähnlich wirksam, wie die Behandlung mit fünfmal 800 mg Aciclovir. Der Anteil der Patienten, bei dem nach 6
Monaten noch Schmerzen bestanden, war geringfügig von 26% auf 19% reduziert. Neben diesem Unterschied besteht ein Vorteil des Valaciclovir in der reduzierten Einnahmefrequenz (3-mal vs 5-mal
täglich), was mit einer verbesserten Patienten-Compliance verbunden sein dürfte. Hinsichtlich toxikologischer Risiken sollte vor allem das teratogene Potential des Virustatikums bedacht werden. Die
"sorgfältige Abwägung von Nutzen und Risiko" bei Anwendung in der Schwangerschaft (Fachinformation des Herstellers) sollte bei Berücksichtigung aller Informationen zu einer generellen Zurückhaltung
bei der Verordnung des Medikamentes an Frauen im gebärfähigen Alter führen.
1. SOUL-LAWTON J, SEABER E et al. Absolute bioavailability and metabolic disposition of valaciclovir, the L-valyl ester of acyclovir, following oral administration to humans. Antimicrob Agents Chemother. 1995;39:2759-64.
2. BEUTNER KR, FRIEDMAN DJ et al. Valaciclovir compared with acyclovir for improved therapy for herpes zoster in immunocompetent adults. Antimicrob Agents Chemother. 1995
Jul;39(7):1546-53.
3. KLUG S, LEWANDOWSKI C et al. Effect of acyclovir on mammalian embryonic development in culture.Arch Toxicol. 1985 Dec;58(2):89-96.
4. CHAHOUD I, STAHLMANN R et al. Gross-structural defects in rats after acyclovir application on day 10 of gestation. Arch Toxicol. 1988 Aug;62(1):8-14.
5. STAHLMANN R, KLUG S et al. Significance of embryo culture methods for studying the prenatal toxicity
of virustatic agents. Reprod Toxicol. 1993;7 Suppl 1:129-43.
6. ALRAHBIA FA, SACKS SL. New antiherpesvirus agents. Their targets and therapeutic potential. Drugs. 1996 Jul;52(1):17-32.
Ergänzungen (Juli 2009)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 1, 1996) sind zahlreiche weitere Arbeiten über Valaciclovir publiziert worden. Insbesondere soll
an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
DWORKIN RH, JOHNSON RW et al. Recommendations for the management of herpes zoster. Clin Infect Dis. 2007 Jan 1;44 Suppl 1:S1-26.
ARORA A, MENDOZA N et al. Double-blind study comparing 2 dosages of valacyclovir
hydrochloride for the treatment of uncomplicated herpes zoster in immunocompromised
patients 18 years of age and older. J Infect Dis.
2008 May 1;197(9):1289-95.
ENGSTRÖM M, BERG T et al. Prednisolone and valaciclovir in Bell's palsy: a randomised,
double-blind, placebo-controlled, multicentre
trial. Lancet Neurol. 2008
Nov;7(11):993-1000.
Ergänzung (2018)
Herpes zoster - neue Erkenntnisse
Eine Übersicht mit dem Titel „Herpes zoster - neue Erkenntnisse zu Epidemiologie, Pathogenese, Therapie und Prävention“ finden Sie im Heft 4, 2008 dieser Zeitschrift.
Ergänzung (2018)
Impfprophylaxe des Herpes zoster
Unter dem Handelsnamen SHINGRIX ist eine Subunit-Vakzine zur Prophylaxe des Herpes zoster im Handel. Sie enthält das rekombinante Antigen E, ein wesentliches Glykoprotein des Virus und ein speziell entwickeltes Adjuvans. In Placebo-kontrollierten klinischen Studien konnte die Wirksamkeit des Impfstoffes nachgewiesen werden. Sie liegt bei über 90% und zwar in allen Altersgruppen von 50- bis zu über 80-jährigen Patienten.