ODEFSEY – vom ATRIPLA über EVIPLERA zwei Schritte zur besseren Verträglichkeit
Unveränderter Text aus Heft 3, 2017
Eine hohe Compliance bzw. Adhärenz des Patienten – also die regelmäßige Einnahme der Arzneimittel –gehört bei der HIV-Infektion zu den wesentlichen Voraussetzungen einer dauerhaft erfolgreichen Therapie. Da zahlreiche Studien gezeigt haben, dass die Zuverlässigkeit der Einnahme umso besser ist, je weniger Tabletten eingenommen werden müssen, stellen Präparate, die drei Wirkstoffe in einer Tablette enthalten, einen wesentlichen Fortschritt bei der Behandlung der HIV-Infektion dar.
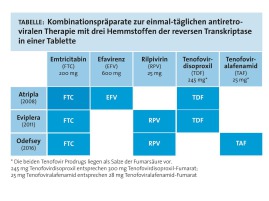
ODEFSEY ist das dritte Kombinationspräparat zur einmal täglichen Verabreichung mit drei Hemmstoffen der reversen Transkriptase in einer Tablette (siehe Tabelle). Die Arzneispezialität enthält Rilpivirin (25 mg), Emtricitabin (200 mg) und Tenofovir-Alafenamid (25 mg) und stellt damit das Ergebnis einer zweistufigen Weiterentwicklung des ATRIPLA dar [Efavirenz (600 mg), Emtricitabin (200 mg) und Tenofovir-Disoproxil (300 mg)].
Tabelle anklicken zum Vergrößern
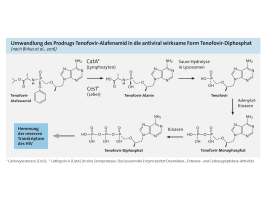
Geht man von diesem Arzneimittel aus, das bereits seit 2008 im Handel ist, wurde 2011 zunächst Efavirenz gegen Rilpivirin ausgetauscht (= EVIPLERA) und in einem zweiten Schritt das Disoproxil-Prodrug von Tenofovir gegen das Alafenamid.1 Beide Maßnahmen bedeuten einen Schritt zu einer besseren Verträglichkeit. Im Vergleich zu Efavirenz verursacht Rilpivirin deutlich weniger ZNS-Wirkungen und das Alafenamid-Prodrug ist hinsichtlich der Wirkungen auf die Nieren und die Knochendichte günstiger zu beurteilen als der Vorgänger. Entscheidend für das günstigere Nutzen-Risiko-Verhälnis des Alafenamids ist die spezielle Form der Aktivierung. Es handelt sich nicht um eine typische Esterverbindung, die bereits im Blut gepalten wird, sondern um ein Phosphoramidat, in dem eine OH-Gruppe des Phosphats durch eine NHR-Gruppe ersetzt wurde. Dadurch erfolgt die Freisetzung nicht im Blut, sondern erst in den Zielzellen (PMBC), also den Lymphozyten (vgl. Abbildung).
Abbildung anklicken zum Vergrößern
Klinische Studien
Es gibt keine Daten zu ODEFSEY aus direkten klinischen Vergleichsstudien mit anderen Kombinationen. Die Sicherheit, Wirksamkeit und Verträglichkeit des Arzneimittels wird durch klinische Studien belegt, in denen die bekannten Wirkstoffe in anderer Kombination eingesetzt wurden, wie zum Beispiel in GENVOYA, einem Kombinationspräparat mit einem Integrase-inhibitor.2 Eine Bioäquivalenzstudie zeigte, dass nach Einnahme von ODEFSEY ähnliche Wirkstoffspiegel von Emtricitabin und Tenofovir-Alafenamid im Blut erreicht werden, wie nach Einnahme von GENVOYA - das anstatt Rilpivirin Elvitegravir enthält - und ähnliche Wirkstoffspiegel von Rilpivirin wie nach Verabreichung von EDURANT (Rilpivirin 25 mg).
In Phase-3-Studien mit EVIPLERA (enthält Rilpivirin) im Vergleich zu ATRIPLA (enthält Efavirenz) wurde festgestellt, dass bei den Patienten, die mit EVIPLERA behandelt wurden und die bei Behandlungsbeginn eine Viruslast von mehr als 100.000 HIV1-RNA-Kopien/ml hatten, ein größeres Risiko für ein virologisches Versagen (17,6 % bei EVIPLERA versus 7,6 % bei ATRIPLA) besteht als bei den Patienten mit einer Viruslast von ≤ 100.000 HIV1-RNA-Kopien/ml (5,9 % bei EVIPLERA versus 2,4 % bei ATRIPLA).2 Die Rate des virologischen Versagens betrug bei mit Rilpivirin behandelten Patienten in Woche 96 11,5 % sowie 5,1 % im Efavirenz-Arm (EVIPLERA vs. ATRIPLA). Daher ist auch ODEFSEY nur bei Patienten mit einer Viruslast ≤100.000 HIV1-RNA-Kopien/ml indiziert, und bei denen das HI-Virus keine Resistenzen gegen die Inhaltsstoffe des Arzneimittels aufweist.3
In zwei Doppelblindstudien wurden bei virologisch supprimierten HIV1-infizierten Patienten die Wirksamkeit und die Sicherheit der Umstellung von ATRIPLA (EFV/FTC/TDF) oder EVIPLERA (FTC/RPV/TDF) auf ODEFSEY untersucht. Die mittlere CD4-Zellzahl zu Studienbeginn lag bei etwa 700 Zellen/ml. In Woche 48 war die Umstellung auf ODEFSEY in Bezug auf die Aufrechterhaltung eines HIV1-RNA-Werts von weniger als 50 Kopien/ml im Vergleich zu Patienten, die in den jeweiligen Studien bei EVIPLERA oder ATRIPLA blieben, nicht unterlegen.2
Tenofovir-Alafenamid besitzt auch eine klinisch relevante Aktivität gegen das Hepatitis B-Virus (vgl. Zeitschrift für Infektionstherapie, Heft 2, 2017, VEMLIDY). Bei Patienten mit einer HIV-HBV-Koinfektion kann es bei Absetzen von ODEFSEY zu einer schweren akuten Exazerbation der chronischen Hepatitis B kommen. Die Patienten sollten daher engmaschig klinisch und durch Labortests überwacht werden.
Arzneimittel-Interaktionen
Bei der gleichzeitigen Anwendung von ODEFSEY mit Arzneimitteln, die CYP3A induzieren, oder bei gleichzeitiger Einnahme von Protonenpumpen-hemmern wurde eine Reduktion der Plasmakonzen-trationen von Rilpivirin beobachtet. Ursache ist der beschleunigte Phase-I-Metabolismus bzw. die verringerte Bioverfügbarkeit aufgrund einer Erhöhung des Magen-pH-Wertes. In beiden Fällen resultiert ein Risiko für virologisches Versagen der Therapie und einer möglichen Resistenz gegenüber Wirkstoffen der NNRTI-Klasse.
ZUSAMMENFASSUNG
Das Kombinationspräparat ODEFSEY enthält neben Rilpivirin und Emtricitabin das besser verträgliche Alafenamid-Prodrug von Tenofovir anstelle des Disoproxil-Esters. Dadurch unterscheidet es sich von EVIPLERA. Beide sollen nicht bei Patienten mit hoher Viruslast (> 100.000 Kopien/ml) angewandt werden. In diversen Studien zeigte sich, dass durch die Veränderung bei den Tenofovir-Derivaten geringere Wirkungen auf die Nieren und auf die Knochendichte resultieren. Mit einer gesamten Wirkstoffmenge von 1.100 mg ist ODEFSEY die kleinste Tablette unter den heute verfügbaren Kombinations-präparaten.
2. Zusammenfassung der Merkmale des Arzneimittels ODEFSEY Januar 2017 (www.ema.eu)
3. Schrijvers R et al. Rilpivirine: a step forward in tailored HIV treatment. Lancet 2011; 378:201-203