Telavancin – ein halbsynthetisches Vancomycin-Derivat
Unveränderter Text aus ZCT Heft 3, 2014
Ergänzungen am Ende des Textes
Das älteste Glykopeptid-Antibiotikum, Vancomycin (VANCOMYCIN LEDERLE u.a.), ist seit mehr als
50 Jahren verfügbar, es wurde jedoch in den ersten Jahrzehnten nur selten angewandt. Heute stellt es bei der Therapie von Infektionen durch Methicillin-resistente Staphylococcus aureus-Infektionen
(MRSA) ein Standard-Therapeutikum dar. Besorgniserregend ist jedoch die zunehmende Resistenz bei Enterokokken und auch bei Staphylokokken. Ein dramatischer Anstieg der Vancomycin-resistenten
Enterokokken in Deutschland wurde zwischen 2007 und 2012 festgestellt. Mittlerweile sind mehr als 10% der Stämme, die auf intensivmedizinischen Stationen isoliert werden, resistent.1
Bemerkenswert ist auch der Nachweis eines Staphylokokken-Stammes mit übertragbarer plasmidkodierter Vancomycin-Resistenz (VanA) bei einem Patienten in Brasilien.2 Vor diesem Hintergrund
erscheint die Entwicklung von neuen Glykopeptiden mit höherer antibakterieller Aktivität begrüßenswert.
Telavancin (VIBATIV) ist ein halbsynthetisches Derivat des Vancomycins, das wegen eines hydrophoben Substituenten auch als Lipoglykopeptid bezeichnet
wird. In den USA ist Telavancin zur Behandlung von komplizierten Hautinfektionen sowie von nosokomialen und beatmungsassoziierten Pneumonien bereits seit 2009 verfügbar. Es soll bei dieser Indikation
laut Zulassungsinformation jedoch nur angewandt werden, wenn andere Alternativen nicht in Frage kommen. In Europa wurde die Zulassung von der EMA bereits im Mai 2011 erteilt, seit kurzem steht es nun
auch in Deutschland zur Verfügung.3,4
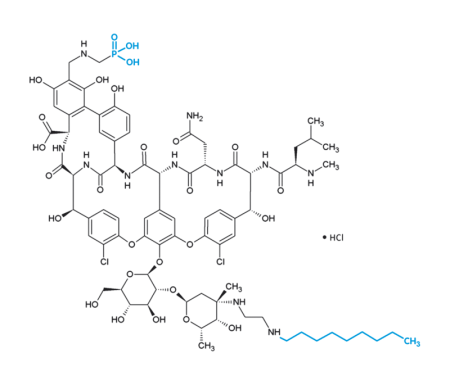
Strukturformel Telavancin. Blau markiert sind die Positionen in denen sich das Molekül von Vancomycin unterscheidet (Decylaminoethyl-Substituent und Phosphomethylamino-methyl-Substituent).
Antibakterielle Aktivität
Telavancin hemmt wie andere Glykopeptide die Zellwandsynthese der Bakterien durch Blockierung des Substrats und stört darüber hinaus die Funktion der Zellmembran. Die in vitro-Aktivität ist gegenüber Vancomycin etwas erhöht, jedoch ebenfalls auf grampositive Bakterien beschränkt (s. Tabelle). Verschiedene Grenzwerte zur Unterscheidung zwischen „resistenten“ und „sensiblen“ Erregern sind veröffentlicht worden. Während in der US-amerikanischen Full Prescribing Information Vibativ im Jahre 2013 Staphylokokken bis zu einer minimalen Hemmkonzentration von 1 mg/l als sensibel betrachtet wurden, liegt dieser Grenzwert in der neuen Arzneimittel-Information vom März 2014 bei nur 0,12 mg/l. Bei EUCAST wird der Grenzwert für Telavancin mit 1mg/l (MRSA) und für Vancomycin mit 2mg/l (S. aureus) bzw. 4 mg/l (Koagulase-negative Staphylokokken) angegeben (www.eucast.org).
In vitro Aktivität von Telavancin im Vergleich zu Vancomycin (MHK90-Werte, mg/l)
|
Erreger |
Vancomycin |
Telavancin
|
|
Staphylococcus aureus (Methicillin-sensibel) |
1 |
0,5 |
|
Staphylococcus aureus (Methicillin-resistent) |
1 |
0,25 |
|
Staphylococcus aureus (VISA)1 |
8 (R) |
1 |
|
Staphylococcus aureus (Koagulase-negativ) |
2 |
0,5 |
|
Enterococcus faecalis*
|
2 |
1 |
|
Enterococcus faecium*
|
1 |
0,25 |
|
Enterokokken (Van A-Resistenz) |
512 (R) |
8 (R) |
|
Enterokokken (Van B-Resistenz) |
512 (R) |
2 (R) |
|
Streptococcus pyogenes
|
0,5 |
0,06 |
|
Streptococcus pneumoniae
|
0,5 |
0,03 |
|
Clostridium difficile
|
1 |
0,25 |
1) VISA = Vancomycin-intermediäre S. aureus Stämme
*Vancomycin-empfindliche Stämme. Die Häufigkeit Vancomycin-resistenter Enterokokken hat in Deutschland in den vergangenen Jahren deutlich zugenommen.
Staphylokokken-Stämme mit MHK-Werten von > 1 mg Telavancin / l und > 2 mg Vancomycin / l werden als resistent eingestuft (mod. nach Saravolatz et al., 2009)
Pharmakokinetische Eigenschaften
Telavancin wird intravenös verabreicht. Nach einer zweistündigen Infusion von 10 mg Telavancin / kg Körpergewicht wurde eine mittlere Spitzenkonzentration von 88 mg/l im Plasma gemessen, der AUC-Wert wurde mit 858 mg/l x h errechnet. Telavancin wird zu etwa 93% an Plasmaproteine gebunden, das Verteilungsvolumen liegt bei 0,13 l/kg. Im epithelialen Flüssigkeitsfilm (ELF) lagen Konzentrationen von Telavancin acht Stunden nach einer Infusion bei 3,7 mg/l. In den Alveolarmakrophagen wurden 24 Stunden nach der Verabreichung Konzentrationen von 42 mg/l gemessen (Plasmakonzentration: 7,3 mg/l). Das Antibiotikum wird überwiegend unverändert mit einer Halbwertzeit von etwa acht Stunden im Urin ausgeschieden, bei eingeschränkter Nierenfunktion (ClCr 30 bis 50 ml/min) soll die Dosierung von 10 auf 7,5 mg/kg reduziert werden, bei deutlicherer Einschränkung (< 30 ml/min) wird eine Dosis von 10 mg/kg nur alle 48 Stunden verabreicht.5,6
Therapeutische Wirksamkeit
In
zwei methodisch gleichartigen Phase-3-Studien (ATTAIN, Assessment of Telavancin for Treatment of Hospital-Acquired Pneumonia) wurden insgesamt 1503 Patienten mit HAP (hospital acquired pneumonia)
entweder mit Telavancin (10 mg/kg alle 24 Stunden) oder Vancomycin (1,0 g alle 12 Stunden) behandelt. Bei mehr als der Hälfte der Patienten lag eine Infektion mit MRSA vor. Unter den 654 klinisch
auswertbaren Fällen lag die Heilungsrate für Telavancin in diesen Doppelblindstudien bei 82,4% und für Vancomycin bei 80,7%.
Die Überlebensraten innerhalb von 28 Tagen nach Beginn der Behandlung waren für Patienten ohne wesentliche Einschränkung
der Nierenfunktion (ClCR >50 ml/min) in beiden Behandlungsgruppen sehr ähnlich, sie zeigten jedoch größere Unterschiede, wenn eine mäßig bis stark ausgeprägte Niereninsuffizienz vorlag. Bei einer
Kreatinin-Clearance von < 30 ml/min überlebten in den vier Wochen nach Studienbeginn 61% (Vancomycin) bzw. 47% (Telavancin) der Patienten.7,8
Unerwünschte Wirkungen
Telavancin behandelte Patienten verspüren sehr häufig einen metallischen oder seifenartigen
Geschmack (Dysgeusie). Bei Patienten mit Haut- und Weichteilinfektionen wurden Übelkeit und Erbrechen ebenfalls häufiger nach Telavancin als nach Vancomycin registriert (Übelkeit: 27% vs. 15%;
Erbrechen 14% vs. 7%). In den Phase-3-Studien bei Patienten mit nosokomialer Pneumonie waren Art und Häufigkeit der unerwünschten Ereignisse nach Behandlung mit Vancomycin oder Telavancin sehr
ähnlich. Gastrointestinale Beschwerden, wie Übelkeit, Diarrhö oder Obstipation waren in beiden Gruppen etwa gleich häufig. Bei 5% der Vancomycin-behandelten Patienten wurde die Studie wegen
unerwünschter Wirkungen abgebrochen, in der Telavancin-Gruppe war dies bei 8% der Fall. Bei 1,2% wurde die Gabe von Telavancin wegen eines akuten Nierenversagens beendet. Die Kreatininkonzentration
war bei den mit Telavancin behandelten Patienten häufiger erhöht (16% vs. 10%). Ein Kreatininanstieg war definiert als eine Erhöhung um >50% über den Ausgangswert und einem maximalen Wert von 1,5
mg/dl unabhängig vom Ausgangswert. Patienten mit erhöhten Ausgangswerten wurden dabei ebenfalls berücksichtigt.
Kontraindikation Schwangerschaft
In tierexperimentellen Studien wurden teratogene Effekte bei drei Säugetierspezies gesehen. In
den Untersuchungen wurden vor allem Fehlbildungen der Extremitäten beobachtet, die bei Dosierungen auftraten, die etwa der Exposition des Menschen nach Standarddosierungen entsprechen. Das
Antibiotikum ist daher kontraindiziert in der Schwangerschaft; vor einer Behandlung von Frauen im gebärfähigen Alter soll eine Schwangerschaft ausgeschlossen werden. Da es erfahrungsgemäß trotz
dieser Vorsichtsmaßnahmen zu Behandlungen in der Schwangerschaft kommt, wurde ein „Telavancin in Pregnancy Registry“ etabliert. Hier sollen in den kommenden Jahren 300 Fälle dokumentiert werden, um
eine Risikoabschätzung vornehmen zu können. Es wird geschätzt, dass dieses Ziel erst in 2019 erreicht wird.
ZUSAMMENFASSUNG:
Telavancin (VIBATIV) ist ein Derivat des Vancomycins (VANCOMYCIN LEDERLE u.a.). Das neue Glykopeptid-Antibiotikum, das neben der Zellwandsynthese auch die Zellmembran der Bakterien schädigt, weist eine etwas höhere in vitro-Aktivität auf als die Ausgangssubstanz. Telavancin wird einmal täglich in einer Dosierung von 10 mg pro Kilogramm Körpergewicht intravenös über eine Stunde infundiert. Das Verteilungsvolumen ist niedrig; das Antibiotikum wird mit einer Halbwertzeit von etwa acht Stunden renal eliminiert. In umfangreichen klinischen Vergleichsstudien zeigte es etwa ähnliche Wirksamkeit wie Vancomycin. Nierenfunktionsstörungen waren häufiger als unter Vancomycin und auch ein Therapieabbruch erfolgte in den klinischen Studien häufiger. Telavancin ist im Tierexperiment teratogen. Das neue Antibiotikum sollte nur angewandt werden, wenn andere Antibiotika nicht in Frage kommen.
Literatur
1. GASTMEIER, P. et
al.
J Antimicrob Chemother 2014;
69:1660-1664
2. ROSSI, F. et al.
N Engl J Med. 2014; 370:1524-1531
3. VIBATIV Full Prescribing Information,
Theravance (März 2014)
4. VIBATIV SPC (Zusammenfassung der Merk-
male des Arzneimittels), (September 2011)
5. GOTFRIED, M.H. et al.
Antimicrob Agents Chemother 2008; 52:92-97
6. SARAVOLATZ, L.D. et al.
Clin Inf Dis 2009; 49: 1908-1914
7. RUBINSTEIN, E. et al.
Clin Inf Dis 2011; 52:31-40
8. COREY, G.R. et al.
Antimicrob Agents Chemother 2014; 58:2030-
2037
9. www.Clinical.trials.gov, VIBATIV Pregnancy
Registry
Ergänzung (2018)
Das Antibiotikum Telavancin ist in der europäischen Union nicht mehr im Handel. Auf Antrag des Zulassungsinhabers hat die EU-Kommission die Zulassung von Telavancin (Vibativ) widerrufen (28. März 2018).