Sofosbuvir - ein Nukleotid-Analogon zur Behandlung der chronischen Hepatitis C
Unveränderter Text aus ZCT Heft 2, 2014
Ergänzungen am Ende des Textes
Die Behandlung der chronischen Hepatitis C unterliegt einem kontinuierlichen Wandel. Mit Telaprevir (INCIVO) und Boceprevir (VICTRELIS)
wurden vor einigen Jahren erstmals Virustatika entwickelt, die direkt die Vermehrung des Hepatitis C-Virus (HCV) hemmen. Beide Stoffe sind Protease-Inhibitoren, die Protease aus HCV wird auch als
NS3/4A bezeichnet (NS = nicht-strukturelles Protein). Als Ergänzung der üblichen Kombinationstherapie aus Ribavirin (REBETOL, COPEGUS) und Peginterferon (PEGINTRON, PEGASYS) konnte mit den neuen
Proteaseinhibitoren eine optimierte klinische Wirksamkeit erreicht werden. Entsprechende Dreierkombinationen mit einem der beiden Proteasehemmer werden seit dem Jahr 2011 zunehmend angewandt (vgl.
www.zct-berlin.de, Neueinführungen).
Leider können nicht alle Patienten damit behandelt werden, denn das Virus existiert in mindestens sechs verschiedenen Genotypen. Die Aktivität der Protease-Inhibitoren ist auf den Genotyp 1
beschränkt, der in Europa und USA bei ca. 70% der Infizierten nachgewiesen werden kann. Ein weiteres Arzneimittel, das gezielt zur Therapie der chronischen Hepatitis C entwickelt wurde, steht jetzt
mit Sofosbuvir (SOVALDI) zur Verfügung. Im Gegensatz zu den Protease-Inhibitoren wirkt es auf alle Genotypen.1
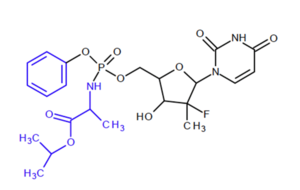
Strukturformel Sofosbuvir (MG 529,5). Die blau markierten Gruppen werden im Organismus abgespalten.
Antivirale Wirkung, Resistenz
Sofosbuvir ist ein Hemmstoff der RNA-abhängigen RNA-Polymerase des HCV (=NS5B). Es handelt
sich um ein am Zuckeranteil fluoriertes und methyliertes Derivat des Uridins. Nukleosid-Analoga müssen intrazellulär zunächst in das entsprechende Triphosphat überführt werden, um die Polymerase zu
hemmen. Da die primäre Umwandlung der Nukleoside in ein Monophosphat nur langsam erfolgt, liegt das Sofosbuvir bereits als Monophosphat vor und stellt damit ein Nukleotid-Analogon dar. Allerdings
wurde die Phosphatgruppe durch zwei Gruppen maskiert, da ansonsten die beiden negativ geladenen Gruppen des Phosphats einen Eintritt in die Zelle erschweren. Diese Gruppen werden zunächst durch
Hydrolyse abgespalten.
In vitro reichen meist sehr niedrige Konzentrationen von Sofosbuvir im Bereich von
weniger als 0,1 μmol (= 53 μg/l) aus, um alle Genotypen des Erregers zu hemmen. In Zellkulturen lassen sich HCV-Replicons mit reduzierter Empfindlichkeit gegenüber Sofosbuvir selektieren. Ursächlich ist die
Substitution S282T in der Polymerase, die mit einer 2- bis 18-fach geringeren Empfindlichkeit einhergeht. In der klinischen Prüfung ergaben sich jedoch keine Hinweise auf entsprechende
Resistenz-entwicklungen während der Therapie.
Pharmakokinetische Eigenschaften
Sofosbuvir ist ein Nukleotid-Prodrug, das in mehreren Schritten metabolisiert wird. Der Hauptmetabolit GS-331007 (>90%) ist nicht antiviral wirksam. Die pharmakokinetischen
Eigenschaften von Sofosbuvir und dem Hauptmetaboliten wurden sowohl bei gesunden Probanden als auch bei Patienten mit Hepatitis C bestimmt.1,2
Sofosbuvir wird nach oraler Verabreichung rasch resorbiert. Die maximalen Plasmakonzentrationen von GS-331007 werden zwei bis vier Stunden nach der Anwendung erreicht. Bei Patienten mit HCV-Infektion
betrug die AUC0–24 von Sofosbuvir und GS-331007 im steady-state etwa 1 μg x h/ml bzw. etwa 7 μg x h/ml. Verglichen mit gesunden Probanden waren die AUC0–24-Werte von Sofosbuvir und
GS-331007 bei HCV-infizierten Patienten um 57% erhöht bzw. um 39% vermindert. Die GS-331007-Konzentration wurde durch eine fettreiche Mahlzeit nicht verändert. Sofosbuvir ist im humanen Plasma zu
etwa 85% an Proteine gebunden.
Sofosbuvir wird in der Leber umfassend in das pharma-kologisch wirksame Nukleosid-Analogon-Triphosphat umgewandelt. Die metabolische Aktivierung umfasst die Hydrolyse der Carboxylestergruppe,
katalysiert durch Cathepsin A (CatA) oder die Carboxyl-esterase 1, sowie die Abspaltung von Phosphoramidat, gefolgt von der Phosphorylierung. Die Dephosphory-lierung führt zur Bildung des
Nukleosid-Metaboliten GS-331007, der nicht effizient rephospho-ryliert werden kann und in vitro keine Aktivität gegen HCV zeigt.
Nach oraler Gabe einer Einzeldosis von 400 mg [14C]-Sofosbuvir wurden im Mittel insgesamt mehr
als 92% der Dosis wiedergefunden, wobei ungefähr 80% im Urin und 14% im Stuhl nachgewiesen wurden. Der Großteil der im Urin wiedergefundenen Sofosbuvir-Dosis bestand aus GS-331007 (78%), während nur
3,5% als Sofosbuvir identifiziert wurden. Diese Daten weisen darauf hin, dass die renale Clearance den Haupteliminationsweg für GS-331007 darstellt, wobei ein großer Teil aktiv sezerniert wird. Die
mediane terminale Halbwertzeit von Sofosbuvir betrug 0,4 Stunden und 27 Stunden für GS-331007.1
Der zirkulierende Hauptmetabolit GS-331007 kann mittels Hämodialyse wirksam entfernt werden. Bei einer vierstündigen Hämodialyse wurden ungefähr 18% der verabreichten Dosis eliminiert. Bei Patienten
mit leichter oder mittelgradiger Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Die Sicherheit des Arzneimittels bei Patienten mit schwerer Nierenfunktionsstörung wurde nicht
untersucht. Eine Untersuchung bei HCV-infizierten Patienten deutet darauf hin, dass die Sofosbuvir- und GS-331007-Exposition durch eine Leberzirrhose nicht nennenswert beeinflusst wird. Eine
Dosisanpassung des Präparates bei Patienten mit Leberfunktionsstörung wird nicht empfohlen.1
Therapeutische Wirksamkeit
Das neue Virustatikum wurde in mehreren Phase-3-Studien klinisch geprüft.3 In der
NEUTRINO-Studie wurden überwiegend Patienten mit Infektionen des Genotyp 1 mit der Dreierkombination aus Sofosbuvir, Ribavirin und Peginterferon 12 Wochen lang behandelt. Nach 12 Wochen waren 89% der
insgesamt 291 Patienten virusfrei und konnten als geheilt angesehen werden. Ähnlich günstig war das Resultat bei einigen Patienten mit einer Infektion mit den Genotypen 4, 5 oder 6.4 Die
FISSION-Studie verglich bei nicht vorbehandelten Patienten mit Infektionen der Genotypen 2 und 3 eine Kombination aus Ribavirin und Sofosbuvir über 12 Wochen mit der Standardtherapie aus Ribavirin
und Peginterferon über 24 Wochen. Beim Genotyp 2 lagen die SVR-Raten (siehe Seite 16) nach 12 Wochen Therapie bei 97% und 78% zu Gunsten des neuen Arzneimittels. Beim Genotyp 3 lagen die Erfolgsraten
bei 56% bzw. 63%.4
Von besonderem Interesse sind die Ergebnisse bei HCV-Infizierten für die Peginterferon zum Beispiel aufgrund von Kontraindikationen nicht in Frage kam und die mit einer Kombination aus Ribavirin plus
Sofosbuvir oder Placebo behandelt wurden (POSITRON-Studie). Bei Infektionen mit den Genotypen 2 und 3 konnte eine Ansprechrate von 78% erzielt werden (161 von 207), dies war bei keinem der 68
Patienten im Placebo-Arm der Fall.5 Patienten, die zuvor auf eine Interferon-Therapie nicht angesprochen hatten, wurden 12 oder 16 Wochen lang mit der Kombination aus Ribavirin und Sofosbuvir
behandelt. Bei diesen mit Genotyp 2 oder 3 Infizierten konnte eine SVR von 50% nach 12 bzw. 73% nach 16 Wochen festgestellt werden (FUSION-Studie).5
Als Ergebnis der umfangreichen klinischen Prüfung ergibt sich folgendes: eine Monotherapie mit Sofosbuvir wird nicht empfohlen. Patienten mit einer chronischen Hepatitis C vom Genotyp 1, 4, 5 oder 6
werden 12 Wochen lang mit einer Dreier-Kombination aus Sofosbuvir plus Ribavirin plus Peginterferon-α behandelt. Falls eine Unverträglichkeit gegenüber Interferon besteht, kann 24 Wochen
lang mit Sofosbuvir plus Ribavirin behandelt werden. Diese duale Therapie ist auch bei einer Infektion mit dem Genotyp 2 (12 Wochen) oder dem Genotyp 3 (24 Wochen) angezeigt. Beim Genotyp 3 ist eine
12-wöchige Dreifachtherapie möglich. In allen Fällen beträgt die Dosierung von Sofosbuvir einmal täglich 400 mg oral.
Verträglichkeit, Interaktionen
Da Sofosbuvir nicht zur Monotherapie angewandt wird, liegen keine Daten zu Verträglichkeit
dieser Substanz bei alleiniger Gabe vor. Die während der klinischen Prüfung beobachteten unerwünschten Wirkungen entsprachen den bekannten Nebenwirkungen der Kombination aus Ribavirin und Interferon,
ohne dass es durch Sofosbuvir zu einer Verstärkung der unerwünschten Wirkungen kam. Im Vordergrund standen dabei die Anämie und andere hämatologische Veränderungen. In den Gruppen, die Sofosbuvir
erhielten, war die Abbruchrate nicht höher als in den Vergleichsgruppen. Nach den bisherigen Erfahrungen kann Sofosbuvir damit als ein gut verträgliches Arzneimittel bezeichnet werden.
Sofosbuvir ist ein Substrat der Effluxproteine P-gp und BCRP, GS-331007 dagegen nicht. Arzneimittel, die starke P-gp-Induktoren im Darm sind [z.B. Rifampicin (EREMFAT u.a.), Johanniskraut (diverse
Handels-namen), Carbamazepin (TEGRETAL u.a.) und Phenytoin (PHENHYDAN)], können zu einer Abnahme der Plasma-konzentration von Sofosbuvir führen und sollten deshalb nicht zusammen mit dem Präparat
angewendet werden. Sofosbuvir und der Hauptmetabolit hemmen P-gp und BCRP nicht, weshalb nicht zu erwarten ist, dass sie die Exposition von Arzneistoffen erhöhen, die Substrate dieser Transporter
sind.1,2
ZUSAMMENFASSUNG:
Mit
Sofosbuvir (SOVALDI) wurde erstmals ein Nukleotid-Analogon zur Behandlung der chronischen Hepatitis C zugelassen. Der Wirkstoff liegt als Prodrug vor und wird zunächst durch Esterasen in ein
monophosphoryliertes Uridin-Derivat umgewandelt, welches dann intrazellulär noch zweimal phosphoryliert wird. Das entstehende Triphosphat hemmt die RNA-Polymerase des Hepatitis C-Virus. Die
Hemmkonzentrationen liegen – je nach Genotyp - bei etwa 0,1 μmol oder niedriger. In mehreren klinischen Studien konnte gezeigt werden, dass mit dem neuen Virustatikum im Gegensatz zu den bisher
verfügbaren Optionen chronische HCV-Infektionen mit allen Genotypen erfolgreich zu therapieren sind und die Behandlungszeiten verkürzt werden können. Die Verträglichkeit in den klinischen Studien war
gut. Wesentliche Interaktionsprobleme mit anderen Arzneistoffen scheint es nicht zu geben, denn Sofosbuvir ist kein Substrat für Cytochrom P450-abhängige Monooxygenasen.
1. Fachinformation SOVALDI 400 mg Filmtabletten Gilead Sciences GmbH, Januar
2014
2. RODRIGUEZ-TORRES, M.
Expert Rev Antiinfect Ther 2013; 11:1269-1279
3. ASSELAH, T.
Expert Opin Pharmacother 2014; 15:121-130
4. LAWITZ, E. et al.
N Engl J Med 2013; 368:1878-1887
5. JACOBSON, I.M. et al.
N Engl J Med 2013; 368:1867-1877
Ergänzungen
September 2014
Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat im September 2014 die Zulassung einer Fixkombination aus dem NS5A-Inhibitor Ledipasvir und Sofosbuvir (HARVONI) für die Behandlung der chronischen Hepatitis C empfohlen. Eine Kurzbeschreibung des Präparates HARVONI in der Zeitschrift für Chemotherapie finden Sie hier.
Februar 2015
Nach Mitteilung des Spitzenverbandes der Krankenkasse (GKK) ist es zu einer Einigung mit dem Hersteller GILEAD bezüglich des Erstattungsbetrages für den bei chronischer Hepatitis C sehr wirksamen, aber extrem teuren Polymerasehemmer Sofosbuvir (SOVALDI) gekommen. Rückwirkend zum 23. Januar 2015 sinkt der bisherige Herstellerabgabepreis von 16.270,00 Euro für 28 Tabletten auf 14.521,00 Euro. Der ausgehandelte Nachlass beträgt somit nicht 27 %, wie vielfach berichtet, sondern nur knapp 11 %. Offensichtlich wird der neue rabattierte Herstellerabgabepreis fälschlicherweise mit dem Apothekenverkaufspreis gleichgesetzt. Der Apothekenverkaufspreis ist jedoch deutlich höher. Er enthält neben dem Herstellerabgabepreis Handelsaufschläge und die Mehrwertsteuer von 19 % und beträgt seit Markteinführung 19.099 Euro, also 714 Euro für eine Tablette. Nach Abzug des gesetzlichen Hersteller-abschlags von 7 % lag der bisherige Preis für eine Packung mit 28 Tabletten Sofosbuvir bei 18.860 Euro. Künftig wird sich der Preis bei 16.840 Euro bewegen.
Dtsch. Ärzteblatt 2015; 112:265
Mai 2015
Rote Hand Brief: Risiko von Herzrhythmusstörungen bei gleichzeitiger Gabe von Sofosbuvir und Amiodaron.
Über das Risiko von klinisch signifikanten Herzrhythmus-störungen informiert ein "Rote Hand Brief". Bradykardien können auftreten bei Behandlung mit Harvoni® (Sofosbuvir + Ledipasvir) oder Daklinza® (Daclatasvir) in Kombination mit Sovaldi® (Sofosbuvir) und gleichzeitiger Therapie mit Amiodaron. Falls die Kombination nicht vermieden werden kann, müssen die Patienten engmaschig überwacht werden. Aufgrund der langen Halbwertzeit von Amiodaron sollen Patienten auch dann überwacht werden, wenn sie Amiodaron in den vorangegangenen Monaten abgesetzt haben.