Moxifloxacin - ein neues Fluorchinolon zur Behandlung von Atemwegsinfektionen
HINWEIS: Moxifloxacin steht seit 2002 auch zur intravenösen Therapie zur Verfügung (mehr...)
Aktuelle Ergänzungen am Ende des Textes
Die Fluorchinolone werden nach einem Vorschlag der Paul-Ehrlich-Gesellschaft für Chemotherapie in vier Gruppen unterteilt (vgl. ZCT 19:27-28,1998). Zur Therapie von Pneumokokken-Infektionen kommen
die Substanzen der Gruppen III und IV in Frage. Trovafloxacin (TROVAN, nicht mehr im Handel) war das erste Chinolon der Gruppe IV – es wurde jedoch
vor einigen Monaten wegen des Risikos hepatischer Reaktionen vom Markt genommen (vgl. ZCT 19:36-37,1998; ZCT 20:30-31,1999). Moxifloxacin (AVALOX) ist ein neu zugelassenes Chinolon der Gruppe IV, das
zur oralen Therapie von Infektionen der Atemwege und bei Weichteil-Infektionen angeboten wird und damit zur Zeit das einzig verfügbare Derivat aus dieser Gruppe darstellt. Ein Blick auf die chemische
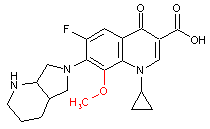
Struktur des neuen Arzneimittels zeigt die enge Verwandtschaft aber auch den Unterschied zu anderen Fluorchinolonen: eine Methoxygruppe in Position 8 (rot) ist von den bisher zugelassenen Chinolonen
nicht bekannt; sie ist offenbar für die vergleichsweise hohe Photostabilität des Moleküls verantwortlich.1
Antibakterielle Wirkung, Resistenz
Moxifloxacin hemmt die bakteriellen Topoisomerasen
II ("Gyrase") und IV und wirkt in vitro gut gegen gramnegative Bakterien, wie zum Beispiel E. coli, Proteus oder K. pneumoniae. Allerdings war die Substanz in diesem Bereich des Spektrums schwächer
wirksam als Ciprofloxacin (CIPROBAY). Insbesondere gegen P. aeruginosa ist Ciprofloxacin (Gruppe II) nach wie vor das aktivste Fluorchinolon.
Anders stellt sich die Situation bei grampositiven Erregern dar. So ist Moxifloxacin gegen Staphylokokken deutlich aktiver als Ciprofloxacin oder Levofloxacin (TAVANIC). Therapeutisch besonders interessant ist die Aktivität des
neuen Chinolons gegen Pneumokokken. Sowohl Penicillin-sensible als auch Penicillin-resistente Stämme von S. pneumoniae werden durch Konzentrationen von 0,125 mg/l gehemmt. Im Vergleich zu
Ciprofloxacin oder Levofloxacin bedeutet dies eine etwa achtfach höhere Aktivität. 1,2,3
Auch weitere klinisch bedeutsame Erreger von Infektionen der Atemwege werden durch niedrige Konzentrationen erfaßt. Dazu gehören H. influenzae (einschließlich Ampicillin (BINOTAL u.a.) -resistenter Stämme), M. catarrhalis, Legionellen, Mykoplasmen und Chlamydien. Auch gegen M. tuberculosis ist Moxifloxain in vitro wirksam (MHK90: 0,5 mg/l).
Zu den besonderen Merkmalen der Gruppe-IV-Chinolone gehört definitionsgemäß ihre Wirkung auf anaerobe Bakterien. Gegenüber B. fragilis ist Moxifloxacin etwa viermal aktiver als Ciprofloxacin (MHK90: 2 mg/l) und auch gegen andere Anaerobier weist die Substanz eine vergleichsweise gute Wirkung in vitro auf.
Pharmakokinetische Eigenschaften
Moxifloxacin wird nach oraler Aufnahme fast vollständig resorbiert: die Bioverfügbarkeit liegt bei etwa 90% und wird durch gleichzeitige Nahrungsaufnahme nicht relevant beeinflußt. Nach der Einnahme einer Tablette mit 400 mg Wirkstoff werden Spitzenkonzentrationen im Plasma von etwa 2,5 bis 4,5 mg/l gemessen. Nach Einmalgabe von 400 mg wurde ein AUC-Wert von 26,9 mg/l x h errechnet.
Fluorchinolone verteilen sich nicht nur extrazellulär, sondern erreichen auch intrazellulär hohe Konzentrationen. Dieses Verhalten drückt sich in einem hohen Verteilungsvolumen aus, das für Moxifloxacin mit 3,5 l/kg berechnet worden ist. Vor allem in den pulmonalen Kompartimenten (Mukosa, epithelialer Flüssigkeitsfilm, Alveolarmakrophagen) wurden deutlich höhere Konzentrationen als im Plasma gemessen.1,4,5
Moxifloxacin wird mit einer Halbwertzeit von etwa 13 Stunden überwiegend hepatisch eliminiert. Nur etwa 20% lassen sich unverändert im Urin nachweisen. Die Substanz wird nicht über Monooxygenasen metabolisiert ("Phase-I-Metabolismus"), sondern in Form von zwei Phase-II-Metaboliten ausgeschieden (Faeces: 35% als N-Sulfo-Metabolit; Urin: 14% als Glucuronid). Da der Metabolismus der Substanz unabhängig von der Aktivität hepatischer Monooxygenasen ist, sind entsprechende Interaktionen nicht zu erwarten. Bei eingeschränkter Nierenfunktion muss die Dosierung nicht reduziert werden, für Dialysepatienten liegen allerdings bisher nur wenige Erfahrungen vor.
Klinische Anwendung
In umfangreichen klinischen Studien erwies sich Moxifloxacin in der empfohlenen Dosierung von 1-mal täglich 400 mg als ebenso wirksam, wie die zum Vergleich verabreichten sonst üblichen Antibiotika [z.B.: Amoxicillin (CLAMOXYL u.a.), Clarithromycin (KLACID)]. Vor allem wurde die Wirksamkeit und Verträglichkeit bei Patienten mit ambulant erworbener Pneumonie, mit einer akuten Exazerbation einer chronischen Bronchitis oder mit Sinusitis untersucht. Moxifloxacin war bei Pneumonie und bei den anderen geprüften Indikationen nach einmal täglicher Gabe ähnlich gut wirksam und verträglich wie die Vergleichspräparate, die 2- oder 3-mal täglich verabreicht wurden. Aufgrund der "1-mal-täglich-Dosierung" kann von einer vergleichsweise günstigen Patientencompliance ausgegangen werden.6
Unerwünschte Wirkungen, Interaktionen
Als häufigste unerwünschte Wirkung traten während der klinischen Prüfung gastrointestinale Störungen auf (Übelkeit, Diarrhö). Zentralnervöse Nebenwirkungen wurden relativ selten beobachtet. Auch Hautreaktionen waren selten; insbesondere kam es nicht zu phototoxischen Reaktionen. Es bestanden keine statistisch signifikanten Unterschiede zu den Vergleichssubstanzen. Damit bestätigten sich in der klinischen Prüfung die Befunde der präklinischen, tierexperimentellen Untersuchungen und die Erfahrungen bei gesunden Probanden, die eine insgesamt günstige Verträglichkeit des Moxifloxacin vermuten lassen. Exakte Aussagen über sehr seltene unerwünschte Wirkungen lassen sich allerdings – wie bei allen Arzneimitteln – zum Zeitpunkt der Einführung nicht machen.
Interaktionen mit anderen Medikamenten, die durch Cytochrom-P450-abhängige Monooxygenasen metabolisiert werden, sind nicht
zu erwarten und wurden in gezielten Studien auch nicht festgestellt. Zu beachten ist allerdings die Interaktion mit Medikamenten, die zwei- oder dreiwertige Metallkationen enthalten (z.B. Magnesium,
Aluminium, Eisen). Bei gleichzeitiger Einnahme mit mineralischen Antazida kommt es - wie bei allen Chinolonen – zu einer deutlich reduzierten Bioverfügbarkeit des Medikamentes.
ZUSAMMENFASSUNG
Mit Moxifloxacin (AVALOX) steht ein neues
Fluorchinolon der Gruppe IV zur oralen Therapie zur Verfügung. Es besitzt von allen Chinolonen die höchste Aktivität gegenüber Pneumokokken und erfaßt auch andere Erreger von Atemwegsinfektionen,
einschließlich der sogenannten atypischen Erreger. Die günstigen pharmakokinetischen Eigenschaften erlauben die 1-mal tägliche Gabe von 400 mg. Die Ergebnisse der klinischen Prüfung zeigten eine gute
therapeutische Wirksamkeit und Verträglichkeit bei den Indikationen ambulant erworbene Pneumonie, purulente Bronchitis und Sinusitis. Leider steht derzeit noch keine Zubereitung zur parenteralen
Therapie zur Verfügung, eine Moxifloxacin-Infusionslösung befindet sich jedoch zur Zeit in der klinischen Entwicklung.
1. BARMAN-BALFOUR JA, WISEMAN LR. Moxifloxacin.
Drugs 1999;
57:363-373.
2. BLONDEAU JM. A review of the comparative in-vitro activities of 12
antimicrobial agents, with a focus on five new respiratory
quinolones'. J. Antimicrob. Chemother. 1999; 43 (Suppl. B): 1-11.
3. BUXBAUM A, STRASCHIL U et al.
Comparative susceptibility to penicillin and
quinolones of 1385 Streptococcus
pneumoniae isolates. Austrian Bacterial Surveillance Network. J. Antimicrob. Chemother. 1999; 43 (Suppl. B):
13-18.
4. STASS H, DALHOFF A et al. Pharmacokinetics, safety, and tolerability of ascending
single doses of moxifloxacin, a new
8-methoxy quinolone, administered to healthy subjects. Antimicrob. Agents. Chemother. 1998;
42:2060-2065.
5. WISE R. Clin. Drug Invest. 1999;17:365-387
6. HÖFFKEN G et al. J. Antimicrob. Chemother. 1999; 44 (Suppl. A):P390
Ergänzungen (Dezember 2009)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 5, 1999) sind zahlreiche weitere Arbeiten über Moxifloxacin publiziert worden. Insbesondere soll an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
REINERT RR, SchLAEGER JJ et al. Moxifloxacin: a comparison with other antimicrobial agents of in-vitro activity against Streptococcus pneumoniae. J Antimicrob Chemother. 1998 Dec;42(6):803-6.
WILSON R,
KUBIN R et al. Five day moxifloxacin therapy compared with 7 day clarithromycin therapy for the treatment of acute exacerbations of chronic bronchitis. J Antimicrob Chemother.
1999;44:501-13.
SULLIVAN JT, WOODRUFF M et al. Pharmacokinetics of a once-daily oral dose of moxifloxacin (Bay 12-8039), a new enantiomerically pure 8-methoxy quinolone. Antimicrob Agents Chemother.
1999 Nov;43(11):2793-7.
SIEGERT R, GEHANNO P et al. A comparison of the safety and efficacy of moxifloxacin (BAY 12-8039) and
cefuroxime axetil in the treatment of acute bacterial sinusitis in adults. The Sinusitis Study Group. Respir Med. 2000 Apr;94(4):337-44.
PARISH
LC, ROUTH HB et al. Moxifloxacin versus cephalexin in the treatment of uncomplicated skin infections. Int J Clin
Pract. 2000 Oct;54(8):497-503.
PETITPRETZ P, ARVIS P et al. Oral moxifloxacin vs high-dosage amoxicillin in the treatment of mild-to-moderate, community-acquired, suspected pneumococcal pneumonia in adults.
Chest. 2001 Jan;119(1):185-95.
JOHNSIN AP, WARNER M et al. Activity of moxifloxacin against clinical isolates of Streptococcus pneumoniae from England and Wales. J Antimicrob Chemother. 2001
Apr;47(4):411-5.
DOERN
GV, HEILMANN KP et al. Antimicrobial resistance among clinical isolates of Streptococcus pneumoniae in the United States during 1999--2000, including a comparison of resistance rates since
1994--1995. Antimicrob Agents Chemother. 2001 Jun;45(6):1721-9.
STASS
H, SCHULY U et al. Effects of sucralfate on the oral bioavailability of moxifloxacin, a novel 8-methoxyfluoroquinolone, in healthy volunteers. Clin Pharmacokinet. 2001;40 Suppl
1:49-55.
RUBINSTEIN E, CAMM J. Cardiotoxicity of fluoroquinolones. J Antimicrob Chemother. 2002 Apr;49(4):593-6.
FINCH
R, SCHURMANN D et al. Randomized controlled trial of sequential intravenous (i.v.) and oral moxifloxacin compared with sequential i.v. and oral co-amoxiclav with or without clarithromycin in patients
with community-acquired pneumonia requiring initial parenteral treatment.
Antimicrob Agents Chemother. 2002 Jun;46(6):1746-54.
GRASSI
C, CASALI L et al. Efficacy and safety of short course (5-day) moxifloxacin vs 7-day ceftriaxone in the treatment of acute exacerbations of chronic bronchitis (AECB). J Chemother. 2002
Dec;14(6):597-608.
MUIJSERS RB, JARVIS B. Moxifloxacin in uncomplicated skin and skin structure infections. Drugs. 2002;62(6):967-73.
WILSON
R, ALLEGRA L et al. Short-term and long-term outcomes of moxifloxacin compared to standard
antibiotic treatment in acute exacerbations of chronic bronchitis. Chest. 2004 Mar;125(3):953-64.
GIORDANO P, SONG J et al. Sequential intravenous/oral moxifloxacin versus intravenous piperacillin-tazobactam followed by oral amoxicillin-clavulanate for the treatment of complicated
skin and skin structure infection. Int J Antimicrob Agents. 2005 Nov;26(5):357-65.
MALANGONI MA, SONG J et al. Randomized controlled trial of moxifloxacin compared with piperacillin-tazobactam and amoxicillin-clavulanate for the treatment of complicated
intra-abdominal infections. Ann Surg. 2006 Aug;244(2):204-11.
TORRES A, GARAU J et
al. Moxifloxacin
monotherapy is effective in hospitalized patients with community-acquired pneumonia: the MOTIV study--a randomized clinical trial.
Clin Infect Dis. 2008 May 15;46(10):1499-509.
WOODHEAD M, BLASI F et al.
Guidelines for the management of adult lower respiratory tract infections.
Eur Respir J. 2005 Dec;26(6):1138-80.
KANELLAKOPOULOU K, PAGOULATOU
A et al. Pharmacokinetics of moxifloxacin in non-inflamed cerebrospinal fluid of humans: implication for a bactericidal effect. J Antimicrob Chemother. 2008 Jun;61(6):1328-31.
BARTH J, JAGER D et al. Single-
and multiple-dose pharmacokinetics of intravenous moxifloxacin in patients with severe hepatic impairment. J Antimicrob Chemother. 2008 Sep;62(3):575-8.
WAGENLEHNER FM, KEES F et al.
Concentrations of moxifloxacin in plasma and urine, and penetration into
prostatic fluid and ejaculate, following single oral administration of 400 mg to healthy volunteers.
Int J Antimicrob Agents. 2008 Jan;31(1):21-6.
BAGO J, PEVEC B et al.
Second-line treatment for Helicobacter pylori infection based on moxifloxacin triple therapy: a randomized controlled trial. Wien Klin Wochenschr. 2009;121(1-2):47-52.