Lenacapavir - ein Kapsid-Inhibitor zur Behandlung der HIV-Infektion
Unveränderter Text aus Heft 5, 2022
Für die Therapie einer HIV-Infektion stehen heute zahlreiche Arzneimittel aus mehreren Klassen zur Verfügung. Zur primären Behandlung werden häufig Kombinationen aus Hemmstoffen der reversen Transkriptase und der Integrase eingesetzt, alternativ stehen Virustatika mit anderen Angriffspunkten zur Verfügung. Trotzdem gibt es therapeutisch schwierige Situationen, wenn bei einem Patienten Mehrklassenresistenz festgestellt wird. Vor diesem Hintergrund ist die Entwicklung einer neuen Substanz, wie Lenacapavir (SUNLENCA), mit innovativem Wirkmechanismus von hohem Interesse. Der Zulassungsantrag des Herstellers Gilead für SUNLENCA wurde im Juni 2022 vom CHMP der Europäischen Arzneimittelagentur (EMA) positiv bewertet, die Zulassung für die EU erfolgte Ende August. Das Arzneimittel ist in Kombination mit anderen antiretroviralen Arzneimitteln zur Behandlung von Erwachsenen mit einer multiresistenten HIV-1-Infektion indiziert, bei denen kein anderes supprimierendes, antivirales Regime zusammengestellt werden kann.1
Struktur, antivirale Wirkung
Lenacapavir ist ein Kapsid-Inhibitor. Zwei Stränge der RNA und die Enzyme des HI-Virus werden von dem Kapsid umschlossen - einer Hülle, die aus dem Protein p24 besteht. Aus p24 werden zunächst zwölf Pentamere und 250 Hexamere gebildet, die sich dann zu einem reifen Kapsid zusammenlagern.
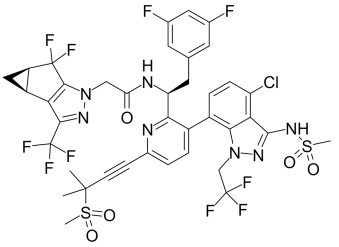
Strukturformel Lenacapavir (GS-6207, MM 968 g/mol). Lenacapavir ist der erste therapeutisch verfügbare Wirkstoff aus der Gruppe der HIV Kapsid-Inhibitoren.
Die intakte Struktur des Kapsids ist essenziell für die Virusreplikation. Interessanterweise spielt es sowohl während der frühen als auch der späten Phase der Replikation eine entscheidende Rolle. Neben der hohen antiviralen Aktivität bereits im pikomolaren Konzentrationsbereich ist auch die sehr langsame Elimination von Lenacapavir bemerkenswert: nach einer subkutanen Injektion werden für sechs Monate ausreichende Wirkspiegel erreicht.1,2,3
Dosierung, Pharmakokinetik
Das neue Arzneimittel wird subkutan im Abstand von sechs Monaten verabreicht. Zuvor werden aber an den ersten beiden Behandlungstagen jeweils zwei Tabletten mit 300 mg Wirkstoff verabreicht, am Tag acht erfolgt die Einnahme einer Tablette mit 300 mg Lenacapavir und am Tag 15 schließlich zwei subkutane Injektionen an verschiedenen Stellen unter die Bauchhaut von jeweils 464 mg. Die Injektion muss dann im Anschluss alle 26 Wochen (± 2 Wochen) erfolgen.1
Lenacapavir ist ein Substrat von P-gp. Die absolute Bioverfügbarkeit von Lenacapavir nach oraler Anwendung ist gering, sie liegt bei ca. 6 bis 10 %. Nach subkutaner Anwendung ist die Resorption dagegen langsam aber vollständig; Spitzenspiegel werden nach 84 Tagen erreicht. Das Verteilungsvolumen im Steady-State wurde mit 976 Liter bei Patienten mit HIV-1-Infektion berechnet. Lenacapavir wird zu 99,8% an Plasmaproteine gebunden. Eine nennenswerte renale Ausscheidung erfolgt nicht, dagegen gibt es zahlreiche Wege der Metabolisierung. Vorherrschend wird es über CYP3A4 und UGT1A1 verstoffwechselt. Die mediane Halbwertszeit nach oraler und subkutaner Anwendung betrug 10 bis 12 Tage bzw. 8 bis 12 Wochen.1
Klinische Prüfung
An einer Phase 3-Studie (CAPELLA-Studie) nahmen zwei Gruppen mit jeweils 36 Patienten mit einer multiresistenten HIV-Infektion teil, bei denen eine virale RNA-Konzentration von 400 Kopien pro Milliliter oder mehr gemessen wurde. Zu Beginn der Behandlung erhielten die Teilnehmer der Gruppe 1 den Wirkstoff (n=24) oder ein Placebo (n=12) bis zum Tag 14 oral. Alle Patienten bekamen zusätzlich die bisherige unzureichende Therapie, es handelte sich damit um eine zweiwöchige, funktionelle Monotherapie mit Lenacapavir. Die Dosierung von Lenacapavir betrug initial 600 mg (Tag 1 und 2), danach 300 mg (Tag 8). In der Lenacapavirgruppe wurde eine Reduktion der Viruskonzentration um mindestens 0,5 log10 Kopien pro Milliliter bei 21 von 24 Teilnehmern ermittelt, in der Placebogruppe war dies bei 2 von 12 Patienten der Fall. Anschließend wurde bei allen Teilnehmern eine Dosis von 927 mg unter die abdominelle Haut gespritzt und zusätzlich wurde die Kombinationstherapie optimiert. Auch die Placebogruppe erhielt Lenacapavir plus eine optimierte Therapie ab Tag 15. Unter diesen Bedingungen war nach 26 Wochen bei mehr als 80% der Patienten die Konzentration der HIV RNA auf weniger als 50 Kopien pro Milliliter gesunken, die Zahl der CD4-Zellen nahm zu. Damit konnte in dieser Studie nachgewiesen werden, dass sich mit Lenacapavir plus optimierten Kombinationspartnern aus den Gruppen der Integrase-, Protease-, nukleosidischen reverse Transkriptase-Inhibitoren oder anderen bei Patienten mit einer multiresistenten HIV-Infektion eine hohe Rate an virologischer Suppression und klinisch bedeutsame Erhöhungen der CD4-Zellzahlen erzielen lassen.4,5
Verträglichkeit, Interaktionen
Während der initialen Phase der CAPELLA-Studie trat unter der Behandlung mit Lenacapavir-haltigen Tabletten im Unterschied zu der Placebogruppe häufig Übelkeit auf (13%). Nach der subkutanen Injektion klagten die Patienten über vorübergehende Schmerzen und Missbehagen, Verhärtungen und entzündliche Reaktionen mit Rötung, Juckreiz und Schwellungen an der Injektionsstelle. Zumindest eines dieser Symptome trat bei 63% der Patienten auf.
Lenacapavir ist ein Substrat und Hemmstoff der CYP3A-abhängigen Monooxygenasen mit mittlerer Potenz. Gleichzeitig verabreichte Stoffe, die CYP3A hemmen, wie zum Beispiel Cobicistat, verursachten nur einen geringen Anstieg der Lenacapavirspiegel. Eine Dosisanpassung ist nach bisherigen Erkenntnissen nicht erforderlich. Die gleichzeitige Gabe von Rifampicin und anderen Induktoren der metabolisierenden Enzyme und Transportproteine (CYP3A, P-gp, UGT1A1), ist kontraindiziert.1
ZUSAMMENFASSUNG:
Der neue Arzneistoff Lenacapavir (SUNLECA) ist in doppelter Hinsicht bemerkenswert: erstens weist er einen neuartigen Wirkungsmechanismus auf indem er mehrere Funktionen des viralen Kapsids hemmt. Zweitens besteht ausreichende antivirale Aktivität für sechs Monate nachdem das Arzneimittel subkutan injiziert wurde. Nur zu Beginn der Zweimal-jährlich-Therapie wird das Arzneimittel oral eingenommen. Die zweimal jährliche Injektion erhöht den Komfort für Patienten und die Compliance. Eine nennenswerte renale Ausscheidung erfolgt nicht, dagegen wird Lenacapavir überwiegend über CYP3A4 und UGT1A1 verstoffwechselt. Die Halbwertszeit nach parenteraler Anwendung betrug acht bis zwölf Wochen. In einer kontrollierten klinischen Studie konnte mit Lenacapavir bei Patienten mit einer unzureichend wirksamen antiretroviralen Therapie eine hohe Rate an virologischem Ansprechen erreicht werden. Abgesehen von vorübergehenden Reaktionen an der Injektionsstelle war die Verträglichkeit in den klinischen Studien gut. Interaktionen mit anderen Arzneistoffen müssen beachtet werden. Da die Kenntnisse über dieses neue Arzneimittel noch sehr limitiert sind, bleibt abzuwarten, welchen Stellenwert es im Spektrum der verfügbaren antiretroviralen Wirkstoffe erhalten wird. Etliche Fragen zur möglichen Resistenzentwicklung, therapeutischen Wirksamkeit und Verträglichkeit sind derzeit noch offen. Insgesamt muss die Entwicklung solch innovativer Arzneimittel, die neue therapeutische Perspektiven eröffnen, jedoch begrüßt werden.
Literatur