Itraconazol
ein neues Azolantimykotikum
Unveränderter Text aus ZCT Heft 4, 1991
Aktuelle Ergänzungen am Ende des Textes
Der Bedarf an wirksamen und verträglichen Antimykotika ist nach wie vor groß, denn mit Amphotericin B (AMPHOTERICIN B SQUIBB) ist zwar ein wirksames Präparat verfügbar, sein Einsatz ist aber wegen
der schweren Nebenwirkungen auf lebensbedrohende Pilzinfektionen beschränkt. Mit Itraconazol (SEMPERA) ist nach Fluconazol (FUNGATA, DIFLUCAN) ("ZCT" 11: 36-37, 1990) das zweite Triazol-Antimykotikum zur systemischen Behandlung von Mykosen
zugelassen worden 1,2.
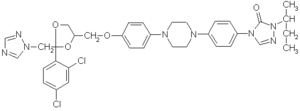
Chemische Struktur
Die chemischen Strukturen von Itraconazol und Ketoconazol (NIZORAL) sind sehr ähnlich: an Stelle des Imidazolringes im Ketoconazol befindet sich im Molekül des Itraconazols ein
Triazolring. Itraconazol ist eine recht lipophile Substanz, es steht nicht zur parenteralen Anwendung zur Verfügung.
Wirkungsmechanismus und antimykotische Aktivität
Itraconazol greift - wie alle Azolantimykotika - in die Biosynthese des Ergosterols, einem wichtigen Bestandteil der Pilzzellmembran, ein. Itraconazol
inhibiert die 14alpha-Demethylierung des Lanosterols. Ursache ist die Komplexbildung zwischen dem Triazolring und dem Eisenion der Demethylase, die in die Gruppe der Cytochrom P450-abhängigen
Monooxygenasen gehört. In der Folge werden verschiedene Funktionen der Membranen gestört (z.B. die Permeabilität und die Aktivität membrangebundener Enzyme). Außerdem führt die reduzierte
Ergosterol-Synthese zu einem (unkoordinierten) Anstieg der Chitin-Synthese. Chitin ist ein Bestandteil der Zellwand der Pilze und seine koordinierte Bildung ist eine Voraussetzung für die reguläre
Septenbildung. Die antimykotische Wirksamkeit der Substanz läßt sich an Hand der in vitro-Untersuchungen nicht befriedigend beschreiben, weil die Resultate in Abhängigkeit vom Testverfahren sehr
variabel sein können und die Wirkung in vitro und in vivo stark voneinander abweichen können. Daher haben in vivo-Untersuchungen zur Wirksamkeit an infizierten Tieren eine besondere Bedeutung. In
solchen Infektionsmodellen war Itraconazol bei Infektionen durch Candida, verschiedene Aspergillus-Arten, Cryptococcus, Histoplasma, Coccidioides und Paracoccidioides wirksam.
Pharmakokinetische Eigenschaften
Itraconazol wird nach oraler Gabe gut resorbiert, die Spitzenspiegel wurden etwa drei bis sechs Stunden nach der Einnahme gemessen. Voraussetzung für eine
nahezu vollständige Resorption ist die Einnahme zusammen mit einer Mahlzeit; die Resorptionsquote nach Nüchterngabe liegt lediglich bei 40%.3
Nach einmaliger Gabe von 100 mg bis 400 mg Itraconazol lagen die Plasmakonzentrationen zwischen 0,11 und 0,55 mg/l; sie erreichten nach mehrfacher Gabe über einen Zeitraum von zwei Wochen Werte
zwischen 0,41 und 1,98 mg/l.
Die Proteinbindung von Itraconazol ist sehr hoch, nur 0,2% der Substanz liegen als freier Wirkstoff vor. Die Gewebepenetration ist gut, insbesondere in die Haut und die Nägel lagert sich Itraconazol
ein. Die Konzentrationen sind in einigen Organen höher als die im Plasma. In der Augenflüssigkeit und vor allem im Liquor werden allerdings keine therapeutisch wirksamen Konzentrationen
erreicht.
Itraconazol wird in der Leber intensiv metabolisiert. Die Ausscheidung erfolgt zum größeren Teil über die Galle, aber in Form von Metaboliten auch über die Niere. Die Dosis hat einen deutlichen
Einfluß auf die Pharmakokinetik. Die Eliminationshalbwertzeit steigt von 15 Stunden nach einmaliger Gabe von 100 mg Itraconazol auf 25 Stunden nach Gabe von 400 mg. Die Eliminationshalbwertzeit
verlängerte sich nach täglicher Gabe von 400 mg über einen Zeitraum von zwei Wochen auf 42 Stunden. Dies wird als Anzeichen einer beginnenden Sättigung des Metabolismus interpretiert.
Eine Beeinträchtigung der Nierenfunktion hatte keinen signifikanten Einfluß auf die Pharmakokinetik des Antimykotikums. Zum Einfluß von Leberschädigungen liegen noch keine Untersuchungen
vor.
Therapeutische Anwendung und Dosierung
Bei Tinea pedis und Tinea manuum ist die Behandlung mit 100 mg Itraconazol täglich der Gabe von 500 mg Griseofulvin (FULCIN S, LIKUDEN M) etwa
gleichwertig. Auch bei Pityriasis versicolor war Itraconazol wirksamer als Placebo. Die Behandlungsdauer sollte einen Monat nicht überschreiten, da für eine längere Einnahmedauer bisher keine
ausreichenden Erfahrungen vorliegen.
Der mögliche Einsatz von Itraconazol bei systemischen Pilzinfektionen ist zur Zeit Gegenstand etlicher Untersuchungen. Kürzlich wurde über "variable" Behandlungsergebnisse bei AIDS-Patienten mit
pulmonaler Aspergillose, die entweder mit Amphotericin B oder Itraconazol behandelt wurden, berichtet 4. Ein Ersatz von Amphotericin B durch Itraconazol oder andere Azolantimykotika ist derzeit nicht
erkennbar: Gegenwärtig ist Amphotericin B immer noch das Standard-Antimykotikum zur Therapie schwerer systemischer Pilzinfektionen.
Nebenwirkungen und Interaktionen
Die vom Hersteller herausgegebene Informationsbroschüre enthält keine detaillierten Angaben zur Verträglichkeit des Präparates. Insgesamt scheint
Itraconazol jedoch besser verträglich zu sein als Ketoconazol. Bei kurzer Behandlungsdauer lag die Inzidenz der unerwünschten Wirkungen bei 7%. Am häufigsten wurden gastrointestinale Störungen,
Kopfschmerzen und Hauterscheinungen beobachtet. Bei 1 bis 2% der Patienten (n > 4000) traten reversible Erhöhungen der Leberenzyme im Serum auf. Höhere Inzidenzen wurden jedoch bei langfristiger
Therapie ermittelt. In einer umfangreichen Studie an etwa 200 Patienten, die langfristig (Median: 5 Monate) mit Dosierungen zwischen 50 und 400 mg Itraconazol behandelt wurden, boten 39% der
Patienten unerwünschten Wirkungen 5. Gastrointestinale Störungen waren auch hier die häufigste Nebenwirkung. Bei etwa 10% der Patienten traten Schwindel und/oder Erbrechen auf, weiterhin wurden
Durchfälle und Flatulenz mit je drei Fällen beobachtet. Veränderte Leberfunktionswerte wurden bei 7% der Patienten festgestellt. Eine Hypokaliämie wurde bei 11 Patienten (7%), eine Erhöhung der
Triglyzeride wurde bei 16 Patienten (9%) registriert.
Die Beeinflussung der hepatischen Monooxygenasen durch die Azolantimykotika ist eine wesentliche Ursache für viele klinisch relevante Arzneimittel-Interaktionen. Die neueingeführten Triazol-Derivate
Fluconazol und Itraconazol scheinen nach den bisher veröffentlichten Untersuchungen ein geringeres Interaktionspotential zu besitzen als Ketoconazol. Dennoch sind einige wichtige Interaktionen zu
beachten: Itraconazol sollte nicht zusammen mit Rifampicin (RIFA u.a.) genommen werden, da Rifampicin die Blutspiegel von Itraconazol senkt. Phenytoin (ZENTROPIL) kann ebenfalls die
Itraconazol-Plasmaspiegel senken. Bei gleichzeitiger Gabe von Itraconazol und Ciclosporin A (SANDIMMUN) ist eine regelmäßige Kontrolle der Blutspiegel des Immunsuppressivums erforderlich. Die
Ciclosporin-Dosis muß entsprechend angepaßt werden, da der Metabolismus des Ciclosporins verlangsamt wird. Die Wirkung von Warfarin (in der BRD nicht im Handel) wurde durch die gleichzeitige Gabe von
Itraconazol verstärkt.
Die Bioverfügbarkeit ist abhängig vom pH-Wert des Magens; daher sollen mineralische Antacida und H2-Antagonisten erst frühestens zwei Stunden nach der Einnahme von Itraconazol genommen
werden.
ZUSAMMENFASSUNG:
Itraconazol (SEMPERA) ist ein neues Azolantimykotikum, das zur systemischen Behandlung von Mykosen zugelassen worden ist.
Zur Zeit ist die Anwendung auf Dermatomykosen beschränkt. Bei dieser Indikation ist die maximale Anwendungsdauer auf vier Wochen begrenzt. Andere Einsatzmöglichkeiten, z.B. bei Aspergillosen, sind
erfolgversprechend, befinden sich jedoch noch im Stadium der Erprobung. Daher läßt sich der klinische Stellenwert derzeit noch nicht sicher beurteilen. Die therapeutischen Erfolgsraten bei der
Behandlung von Dermatomykosen sind vergleichbar mit denen anderer Antimykotika, so daß Verträglichkeit und Preis die Position des neuen Arzneimittels entscheidend mitbestimmen werden.
Es sind zwar einige Interaktionen mit anderen Arzneistoffen festgestellt worden; die bisher vorliegenden Erfahrungen deuten jedoch auf ein - im Vergleich zum Ketoconazol - geringeres
Interaktionspotential hin.
Literatur:
1. GRANT, S.M., CLISSOLD, S.P. Drugs, 37: 310-344, 1989
2. NN Rev. Infect. Dis.9 (Suppl. 1): S1-S152, 1987
3. HARDIN, T.C. et al. Antimicrob. Agents Chemother. 32: 1310-1313,
1988
4. DENNING, D.W. et al. N. Engl. J. Med. 324: 654-662, 1991
5. TUCKER, R.M. et al. J. Antimic. Chemother. 26: 561-566,
1990
Aktuelle Ergänzungen (August 2002)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 4, 1991) sind zahlreiche weitere Arbeiten über Itraconazol publiziert worden. Insbesondere soll an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
Haria, M., Bryson,.H.M., Goa,
K.L. Drugs 1996; 51: 585-620 Erratum: Drugs 1996; 52: 253
Gupta, A.K. et al. Int. J. Dermatol. 1998; 37: 303-8
Jennings, T.S., Hardin, T.C. Ann. Pharmacother. 1993; 27:
1206-1211
Aktuelle Ergänzungen (Januar 2005)
Durch Zusatz von Cyclodextrin kann das lipophile Itraconazol in Lösung gebracht werden; entsprechende Zubereitungen stehen zur oralen und intravenösen Gabe zur Verfügung (s. ZCT Heft 1, 2005)