Fluconazol - ein neues Azolantimykotikum zur oralen und intravenösen Anwendung
Unveränderter Text aus ZCT Heft 5, 1990
Aktuelle Ergänzungen am Ende des Textes
Angesichts des mangelhaften Arzneimittelangebotes zur antimykotischen Therapie kommt verständlicherweise neuen Substanzen, die zur systemischen Behandlung
von Pilzinfektionen geeignet sind, großes Interesse entgegen. Bereits vor zwei Jahren berichteten wir über neue "Azolantimykotika", die sich in klinischer Erprobung befinden ("ZCT" 9: 33-34, 1988).
Mit Fluconazol (DIFLUCAN) wurde jetzt eines dieser Präparate zugelassen und erweitert damit das bisher spärliche Angebot in diesem zunehmend wichtigen Bereich antimikrobieller Chemotherapie
[1,2,3].
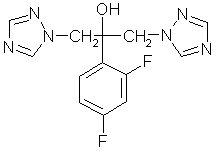
Chemische Struktur
Charakteristische Bestandteile des Fluconazol-Moleküls sind zwei Triazol-Reste, eine tertiäre Alkoholgruppe und ein mit zwei Fluor-Atomen substituierter
Phenyl-Rest. Es besteht also nur eine entfernte Verwandtschaft mit den Imidazol-Derivaten Miconazol (DAKTAR) und Ketoconazol (NIZORAL). Im Vergleich zu diesen Chemotherapeutika besitzt Fluconazol eine bessere Wasserlöslichkeit.
Wirkungsmechanismus und antimykotische Aktivität
Fluconazol hemmt - ähnlich wie die Imidazol-Antimykotika - die P450-abhängige Demethylierung von Lanosterol zu Ergosterol. Der Mangel dieses wichtigen
Bestandteiles der Membran von Pilzzellen bewirkt eine Veränderung der Membranpermeabilität und führt schließlich zur Hemmung des Pilzwachstums. Fluconazol hemmt entsprechende Enzyme (Demethylasen)
aus Säugetierzellen erst bei deutlich höheren Konzentrationen. Im Vergleich mit Ketoconazol scheint der Einfluß des Fluconazols auf diese Enzyme geringer zu sein.
Die Ergebnisse der in vitro-Untersuchungen geben die antimikrobielle Aktivität der Substanz nur unzureichend wieder. Während Fluconazol bei den in vitro-Untersuchungen eine geringere Aktivität zeigt
als z.B. Ketoconazol, sind die Ergebnisse aus den in vivo-Untersuchungen häufig umgekehrt. Dieser Umstand erschwert eine Bewertung der fungistatischen Wirksamkeit des Fluconazols; wegen der
fraglichen Relevanz der in vitro-Daten soll auf eine Wiedergabe an dieser Stelle verzichtet werden. Anhand von Infektionsmodellen konnte gezeigt werden, daß Fluconazol bei Infektionen durch Candida,
Cryptococcus, Aspergillus, Blastomyces, Coccidioides und Histoplasma bei Labortieren wirksam war.
Pharmakokinetische Eigenschaften
Nach oraler Gabe wird Fluconazol innerhalb von zwei Stunden nahezu vollständig resorbiert. Die Bioverfügbarkeit von > 90% wird auch durch
Nahrungsaufnahme oder gleichzeitige Gabe von H2-Antagonisten wie Cimetidin (TAGAMET) nicht reduziert. Nach einmaliger Gabe von 100 mg bis 400 mg wurden bei gesunden Probanden Plasmakonzentrationen
zwischen 1,9 und 6,7 mg/l gemessen. Bei mehrfacher Gabe liegen die Konzentrationen etwa 2- bis 3-mal höher. Die Bindung an Plasmaeiweiß ist mit 11% niedrig, das Verteilungsvolumen beträgt 0,8 l/kg
Körpergewicht. Die Konzentrationen in Körperflüssigkeiten wie Liquor, Speichel, Sputum und Vaginalsektret entsprechen etwa den Plasmakonzentrationen. Fluconazol wird überwiegend renal eliminiert, bis
zu 80% der Substanz finden sich unverändert im Urin. Die Eliminationshalbwertzeit beträgt etwa 30 Stunden und verlängert sich bei eingeschränkter Nierenfunktion. In diesen Fällen muß die Dosierung
reduziert werden.
Therapeutische Anwendung und Dosierung
Bei Candidiasis der Mundhöhle oder des Ösophagus ist die Behandlung mit 50 bis 100 mg Fluconazol am Tag etwa ebenso wirksam wie die Behandlung mit 200 bis
400 mg Ketoconazol. Auch bei vaginaler Candidiasis war eine einmalige Gabe von 150 mg Fluconazol etwa ebenso wirksam wie eine mehrtägige Therapie mit Ketoconazol oder die lokale Anwendung von
Clotrimazol (CANESTEN) oder Econazol (GYNO-PEVARYL). Ähnliches gilt bei Haut- und Haarmykosen durch Dermatophyten. Die Bedeutung der neuen Substanz zur Behandlung systemischer Candida-Infektionen
kann noch nicht beurteilt werden. Derzeit gilt Amphotericin B (AMPHO-MORONAL u.a.) bei diesen lebensbedrohlichen Erkrankungen noch als das Mittel der Wahl.
Besonderes Interesse hat die gute Wirksamkeit des neuen Chemotherapeutikums bei Cryptokokken-Meningitis (häufige Todesursache bei AIDS-Patienten!) gefunden. Neueste Ergebnisse zeigen jedoch, daß die
aggressivere Therapie mit Amphotericin B wahrscheinlich doch wirksamer ist. Allerdings scheint Fluconazol geeigneter zu sein, um Rezidive dieser Erkrankung zu verhindern.
Nebenwirkungen und Interaktionen
Während der klinischen Erprobung lag die Rate unerwünschter Wirkungen bei 16% der Patienten. Beschwerden wie Übelkeit (3,7%), Erbrechen (1,7%) und Diarrhö (1,5%) sowie Kopfschmerzen (1,9%) und
Exantheme (1,8%) waren am häufigsten. Bei der Interpretation dieser Resultate muß berücksichtigt werden, daß nicht wenige der Patienten zum Teil schwere Grunderkrankungen aufwiesen, die ebenfalls als
Ursache der beobachteten Beschwerden in Frage kommen. Bei 1,5% der Patienten wurde die Behandlung aufgrund von Nebenwirkungen abgebrochen und bei 1,3% aufgrund von Veränderungen bei den Laborwerten
(z.B. Transaminasenerhöhung). In einem Bereich von 50 bis 400 mg wurde keine Dosisabhängigkeit der Inzidenzen unerwünschter Begleiterscheinungen festgestellt.
Bei gleichzeitiger Behandlung mit Phenytoin (ZENTROPIL u.a.) muß mit einem klinisch relevanten Anstieg der Plasmakonzentrationen des Antiepileptikums gerechnet werden; eine Überprüfung der
Plasmaspiegel ist erforderlich. Auch die Spiegel von Ciclosporin (SANDIMMUN) können bei gleichzeitiger Gabe erhöht sein, doch sind die Ergebnisse bisher noch widersprüchlich. Bis genauere Daten
vorliegen, sollte zunächst auch bei anderen Arzneimitteln, die durch Monooxygenasen metabolisiert werden, mit der Möglichkeit von Interaktionen gerechnet werden, wenn gleichzeitig mit Fluconazol
behandelt wird.
ZUSAMMENFASSUNG:
Fluconazol (DIFLUCAN) stellt eine Bereicherung der therapeutischen Möglichkeiten bei Pilzinfektionen - insbesondere bei
Candida - dar. Aufgrund der günstigen physiko-chemischen und pharmakokinetischen Eigenschaften kann des Azolantimykotikum 1-mal am Tag oral oder intravenös verabreicht werden. Da die therapeutischen
Erfolgsraten bei lokalen Candida-Infektionen mit den Ergebnissen anderer Antimykotika etwa vergleichbar sind, werden Faktoren wie Verträglichkeit und Preis die Position des neuen Präparates
wesentlich bestimmen. Die Wirksamkeit bei schweren systemischen Candida-Infektionen läßt sich noch nicht abschließend beurteilen. Neue therapeutische Möglichkeiten könnten durch Fluconazol bei der
Therapie oder Rezidivprophylaxe der Cryptokokken-Meningitis gegeben sein. Weitere klinische Studien sind erforderlich, um den Stellenwert dieser vielversprechenden Substanz klarer zu
beschreiben.
Literatur:
1) GRANT, S. und
CLISSOLD, S.P. Drugs 39: 877-916, 1990
2) GALGIANI, J.N. Ann. Intern. Med. 113: 177-179, 1990
3) NN Rev. Inf. Dis. 12 (Suppl. 3): S263-S389, 1990
Ergänzungen (August 2002)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 5,
1990) sind zahlreiche weitere Arbeiten über Fluconazol publiziert worden. Insbesondere soll an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
Goa, K.L., Barradell, L.B. Drugs
1995; 50: 658-690
Gearhart, M.O. Ann.
Pharmacother. 1994; 28: 1177-1181
Baciewicz. A.M., Baciewicz, F.A. Jr. Arch. Intern. Med. 1993 Sep.
13;153(17):1970-1976
Ergänzungen (Dezember 2009)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 5, 1990) sind zahlreiche
weitere Arbeiten über Fluconazol publiziert worden. Insbesondere soll an dieser Stelle auf die folgenden Arbeiten hingewiesen werden:
COMO JA, DISMUKES WE. Oral azole drugs as systemic antifungal
therapy.
N Engl J Med. 1994 Jan
27;330(4):263-72.
PERRY CM, WHITTINGTON R et al.
Fluconazole. An update of its antimicrobial activity, pharmacokinetic properties, and therapeutic use in vaginal candidiasis. Drugs. 1995 Jun;49(6):984-1006.
WILCOX CM, DAROUCHIE RO et al. A
randomized, double-blind comparison of itraconazole oral solution and fluconazole tablets in the treatment of esophageal candidiasis.
J Infect Dis. 1997
Jul;176(1):227-32.
ALBENGRES E, LE LOUET H et
al. Systemic antifungal agents. Drug interactions of clinical significance.
Drug Saf. 1998 Feb;18(2):83-97.
LOMAESTRO BM, PIATEK MA. Update
on drug interactions with azole antifungal agents.
Ann Pharmacother. 1998 Sep;32(9):915-28.
WINSTON DJ, PAKRASI A et
al. Prophylactic
fluconazole in liver transplant recipients. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1999 Nov
16;131(10):729-37.
VENKATAKRISHNAN K, VON MOLTKE LL
et al. Effects of the antifungal agents on oxidative drug metabolism: clinical relevance. Clin Pharmacokinet. 2000 Feb;38(2):111-80.
MARR KA, SEIDEL K et al.
Prolonged fluconazole prophylaxis is associated with persistent protection against candidiasis-related death in allogeneic marrow transplant recipients: long-term follow-up of a randomized,
placebo-controlled trial. Blood. 2000 Sep
15;96(6):2055-61.
PELZ RK, HENDRIX CW et al.
Double-blind placebo-controlled trial of fluconazole to prevent candidal infections in critically ill surgical patients. Ann Surg. 2001 Apr;233(4):542-8.
ALLY R, SCHURMANN D et al. A randomized, double-blind,
double-dummy, multicenter trial of voriconazole and fluconazole in the treatment of esophageal candidiasis in immunocompromised patients.
Clin Infect Dis. 2001 Nov
1;33(9):1447-54. Epub 2001 Sep 26.
PEA F, FURLANUT M.
Pharmacokinetic aspects of treating infections in the intensive care unit: focus on drug interactions. Clin Pharmacokinet. 2001;40(11):833-68.
JACOBS S, PRICE EVANS DA et
al. Fluconazole improves
survival in septic shock: a randomized double-blind prospective study. Crit Care Med. 2003 Jul;31(7):1938-46.
DE PUZINO C, GARUTTI P et
al. Fluconazole 150 mg
single dose versus itraconazole 200 mg per day for 3 days in the treatment of acute vaginal candidiasis: a double-blind randomized study.
Eur J Obstet Gynecol Reprod Biol. 2003 Feb 10;106(2):193-7.
MAERTENS JA. History of the
development of azole derivatives.
Clin Microbiol Infect. 2004 Mar;10 Suppl 1:1-10.
YU DT, PETERSON JF et
al. Frequency of potential azole drug-drug interactions and consequences of potential fluconazole drug interactions. Pharmacoepidemiol Drug Saf. 2005
Nov;14(11):755-67.
SHAKERI-NEJAD K, STAHLMANN R.
Drug interactions during therapy with three major groups of antimicrobial agents. Expert Opin Pharmacother. 2006 Apr;7(6):639-51.
SCHUSTER MG, EDWARDS JE Jr et al. Empirical fluconazole
versus placebo for intensive care unit patients: a randomized trial.
Ann Intern Med. 2008 Jul 15;149(2):83-90.
HORN DL,
NEOFYTOS D et al. Epidemiology and outcomes of
candidemia in 2019 patients: data from the prospective antifungal therapy alliance registry. Clin Infect Dis. 2009 Jun 15;48(12):1695-703.