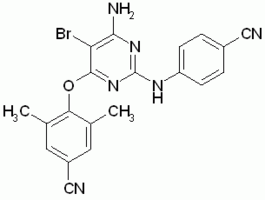
Etravirin - eine weitere Therapieoption bei HIV-Infektion
Unveränderter Text aus Heft 1, 2009
Aktuelle Ergänzungen am Ende des Textes
In den 25 Jahren seit der Entdeckung von HIV wurden insgesamt 25 Wirkstoffe zur Behandlung der HIV-Infektion zugelassen. Diese Entwicklung war nicht vorhersehbar, denn Arzneimittel zur Behandlung von
Virusinfektionen waren vor mehr als zwei Jahrzehnten kaum verfügbar. Allgemein wurde davon ausgegangen, dass die Vermehrung von Viren wegen der engen Verflechtung mit dem Wirtsstoffwechsel
therapeutisch nicht zu beeinflussen wäre. Die intensive Suche nach Wirkstoffen gegen HIV hat diese Lehrmeinung grundsätzlich geändert und unter anderem dazu geführt, dass auch andere Virusinfektionen
heute durchaus behandelbar sind. [1]
Die Möglichkeiten der antiretroviralen Kombinationstherapie sind im vergangenen Jahr durch die Einführung von Maraviroc (CELSENTRI) und Raltegravir (ISENTRESS) wesentlich erweitert worden: damit stehen erstmals Vertreter von zwei neuen Wirkstoffklassen - den
Eintrittsinhibitoren und den Integraseinhibitoren - zur Verfügung. Entwicklungspotenzial steckt allerdings offensichtlich auch noch in den länger bekannten Stoffgruppen, wie zum Beispiel den
Hemmstoffen der reversen Transkriptase (RT). Etravirin (INTELENCE) ist ein nicht-nukleosidischer Inhibitor des Enzyms (NNRTI), der seit kurzem zur Behandlung der HIV-Infektion zugelassen ist. Andere
Stoffe dieser Arzneimittelgruppe, wie zum Beispiel Efavirenz (SUSTIVA), werden seit mehr als zehn Jahren erfolgreich in der HIV-Therapie eingesetzt.
Antivirale Wirkung
Etravirin ist ein Diarylpyrimidinderivat, das direkt
an die reverse Transkriptase von HIV-1 bindet und die RNA-abhängige DNA-Polymerase blockiert. Im Unterschied zu den nukleosidischen Virustatika binden die nicht-nukleosidischen Inhibitoren nicht
direkt an das katalytische Zentrum des Enzyms, sondern an eine benachbarte Stelle des Proteins. Etravirin wirkt auch bei den meisten Virusmutanten, die gegen andere NNRTI resistent sind. Dies könnte
mit der Flexibilität des Moleküls zusammenhängen, das sich in Teilen drehen und sich innerhalb der Bindungstasche reorientieren kann, wenn Mutationen vorliegen. Die antivirale Wirkung (EC50) wird
bereits bei Konzentrationen von 1,4 bis 4,8 nmol/l beobachtet.
Resistenz-assoziierte Mutationen sind auch gegen dieses Virustatikum identifiziert worden; doch sind dazu wenigstens zwei Mutationen notwendig, während bei den anderen Inhibitoren meistens eine
Mutation ausreichend ist. [2]
Pharmakokinetische Eigenschaften
Etravirin wird zusammen mit Nahrung deutlich besser
resorbiert und soll daher nicht nüchtern genommen werden. Es ist zu etwa 99,9% an Albumin und andere Plasmaproteine gebunden. Etravirin wird durch CYP3A4, CYP2C9 und CYP2C19 metabolisiert und in
einer Phase-II-Reaktion durch die Uridindiphosphat-Glukuronosyl-Transferase (UDPGT) glukuronidiert. Nach Verabreichung einer radioaktiv markierten Dosis wurden etwa 94% im Stuhl und 1,2% im Urin
nachgewiesen. Der Anteil an unverändertem Wirkstoff lag in den Fäzes bei über 80% und entspricht wahrscheinlich dem nicht-resorbierten Anteil des Arzneimittels. Die terminale Halbwertzeit betrug ca.
30 bis 40 Stunden. [2,3]
Therapeutische Wirksamkeit
Etravirin ist zugelassen zur Behandlung
antiretroviral vorbehandelter Erwachsener, die mit HIV-1 infiziert sind. Es wird nur in Kombination mit anderen antiretroviral wirksamen Arzneimitteln verordnet. Die empfohlene Anfangsdosis beträgt
zweimal täglich zwei Tabletten mit je 100 mg Wirkstoff, die nach einer Mahlzeit eingenommen werden sollen. Nicht empfohlen wird die Anwendung bei Patienten mit schwerer Leberfunktionsstörung sowie
bei Kindern und Jugendlichen.
Die Zulassung beruht auf zwei Phase-III-Studien in denen insgesamt rund 1200 vorbehandelte Patienten mit Resistenz gegen andere nicht-nukleosidische Hemmstoffe der reversen Transkriptase (DUET-1 und
DUET-2) behandelt wurden. [4,5]
Beide Doppelblindstudien wiesen ein identisches Design auf, wurden aber in unterschiedlichen Ländern durchgeführt: Es wurde die Wirksamkeit von Etravirin gegen Placebo untersucht - jeweils in Kombination mit geboostertem Darunavir (PREZISTA) sowie mindestens zwei weiteren antiviralen Arzneistoffen, die individuell für den jeweiligen Patienten ausgewählt wurden. Eine Zwischenauswertung der Studien erfolgte nach 24 Wochen. Etravirin senkte die Viruslast in beiden Studien in einem ähnlichen Ausmaß und signifikant deutlicher als Placebo. Mittlerweile liegen auch Erfahrungen nach einer Behandlungsdauer von 48 Wochen und bei höheren Tagesdosen vor, die die ersten günstigen klinischen Erfahrungen prinzipiell bestätigen. Die Anzahl der Patienten mit einer Viruslast unter 50 Kopien/ml Blut lag bei 60% der Patienten in der Verumgruppe, aber nur bei 40% in der Placebogruppe. [6,7,8]
Verträglichkeit
Die Verträglichkeit von Etravirin in den
Zulassungsstudien war gut. [2,3,4,5] Die Rate der ernsthaften, behandlungsbedingten unerwünschten Wirkungen lag bei 2,3% der Etravirin-Patienten im Vergleich zu 2,5% der Placebo-Patienten. Bei
HIV-infizierten Patienten kommt es relativ häufig zu Hautreaktionen im Zusammenhang mit einer Arzneimitteltherapie und praktisch alle Virustatika verursachen Hautreaktionen, allerdings mit sehr
unterschiedlichem Schweregrad.9 Auch unter der Behandlung mit Etravirin waren Hautausschläge mit 17% die häufigsten Nebenwirkungen im Vergleich zu 9,4% in der Placebogruppe. Die Hautreaktionen traten
überwiegend innerhalb der ersten beiden Wochen nach Behandlungsbeginn auf und waren meist rasch reversibel. Sie waren bei Frauen häufiger als bei Männern und führten bei 2,2% der Etravirin-Patienten
zum Therapieabbruch. Insgesamt wurde die Therapie mit Etravirin bei 5,8% der Patienten wegen unerwünschter Ereignisse abgebrochen (Placebo: 4,5%).
Interaktionen
Die Substanz ist ein Induktor von CYP3A4 sowie ein
Inhibitor von CYP2C9 und CYP2C19. Daraus ergeben sich zahlreiche Möglichkeiten für Wechselwirkungen mit anderen Arzneimitteln. Die gleichzeitige Gabe von ungeboosterten Proteasehemmern sowie von
Ritonavir-geboostertem Tipranavir (APTIVUS) ist kontraindiziert, weil die Plasmakonzentrationen von
Etravirin in dieser Kombination um ca. 76% reduziert werden.3 Dagegen können wahrscheinlich Ritonavir-geboostertes Atazanavir (REYATAZ), Darunavir (PREZISTA), Lopinavir (KALETRA) und Saquinavir (INVIRASE, FORTOVASE) gleichzeitig gegeben
werden. Bei gleichzeitiger Gabe von Maraviroc sollte die Dosis des Eintrittsinhibitors angepasst werden.
ZUSAMMENFASSUNG
Etravirin (INTELENCE) ist ein nicht-nukleosidischer
Hemmstoff der reversen Transkriptase, der zusammen mit anderen Substanzen zur antiretroviralen Kombinationstherapie angewandt werden kann. Es ist meist auch gegen Viren wirksam, die sich resistent
gegenüber anderen Vertretern dieser Wirkstoffgruppe, wie zum Beispiel Efavirenz (SUSTIVA), verhalten. Die therapeutische Wirksamkeit wurde in zwei Placebo-kontrollierten Doppelblindstudien
nachgewiesen, in denen Darunavir (PREZISTA) als Proteaseinhibitor eingesetzt wurde. Etravirin ist ein Induktor des CYP3A4 und ein Inhibitor der CYP2C-Isoenzyme, daraus ergeben sich zahlreiche
Interaktionsmöglichkeiten, die bei der Auswahl der Kombinationspartner und bei gleichzeitiger Gabe anderer Medikamente außerhalb der antiretroviralen Therapie beachtet werden müssen. Insgesamt war
die Verträglichkeit gut, Hautausschläge waren die häufigsten unerwünschten Reaktionen. Insbesondere vor dem Hintergrund der zunehmenden Resistenz bei HIV stellt Etravirin eine Bereicherung der
Möglichkeiten im Rahmen der antiretroviralen Kombinationstherapie dar.
1. DECLERCQ, E.
Intern J Antimicrob Agents 2009 (online)
2. DEEKS ED, KEATING GM. Etravirine.
Drugs. 2008;68(16):2357-72.
3. Fachinfo INTELENCE Janssen-Cilag International, Belgien
4. MADRUGA JV, CAHN P et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced
HIV-1-infected patients in DUET-1: 24-week results from a randomised, double-blind,
placebo-controlled
trial. Lancet. 2007 Jul 7;370(9581):29-38.
5. LAZZARIN A, CAMPBELL T et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced
HIV-1-infected patients in DUET-2: 24-week results from a randomised, double-blind, placebo-controlled
trial. Lancet. 2007 Jul 7;370(9581):39-48.
6. MONTANER J, YENI P et al. Safety, tolerability, and preliminary efficacy of 48 weeks of etravirine
therapy in a phase IIb dose-ranging study involving treatment-experienced patients with HIV-1 infection.
Clin Infect Dis. 2008 Oct 1;47(7):969-78.
7. COHEN CJ, BERGER DS et al. Efficacy and safety of etravirine (TMC125) in treatment-experienced
HIV-1-infected patients: 48-week results of a phase IIb trial. AIDS. 2009 Jan 28;23(3):423-6.
8. WILSON LE, GALLANT JE. HIV/AIDS: the management of treatment-experienced HIV-infected patients:
new drugs and drug combinations. Clin Infect Dis. 2009 Jan 15;48(2):214-21.
9. BORRAS-BLASCO J, NAVARRO-RUIZ A et al. Adverse cutaneous reactions associated with the newest
antiretroviral drugs in patients with human immunodeficiency virus infection.
J Antimicrob Chemother. 2008 Nov;62(5):879-88.
Aktuelle Ergänzungen (November 2012)
|
Hinweis: |