Entecavir - eine neue Therapieoption bei Hepatitis B
Unveränderter Text aus Heft 5, 2006
Aktuelle Ergänzungen am Ende des Textes
Die Moleküle der physiologischen Nukleoside bieten zahlreiche Möglichkeiten für chemische Modifikationen. Mittlerweile sind mehr als ein Dutzend Nukleosid-Analoga zur Therapie von Virusinfektionen im
Handel. Die neueste Substanz aus dieser Arzneimittelgruppe ist Entecavir (BARACLUDE), das unlängst zur Therapie der chronischen Hepatitis B zugelassen wurde. [1] Es unterscheidet sich vom
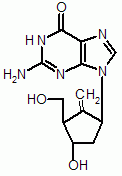
physiologischen Guanosin nur geringfügig: der Zuckeranteil wurde durch einen substituierten Cyclopentylrest ersetzt. Neben Lamivudin (EPIVIR) und Adefovir (HEPSERA) steht damit ein drittes Nukleosid-Analogon zur oralen Therapie der chronischen Hepatitis B zur Verfügung.
[2]
Allen bisher bekannten Therapien der chronischen Hepatitis B ist gemeinsam, dass sie nur zu einer Unterdrückung der viralen Replikation führen. Eine Eradikation der Viren und damit Heilung der Erkrankung ist mit den derzeit verfügbaren Mitteln nicht erreichbar. Vor diesem Hintergrund kommt der prophylaktischen Gabe der Hepatitis B-Vakzine (ENGERIX u.a.) eine besondere Bedeutung zu. Sie wird seit 1995 von der STIKO für Kinder und Jugendliche unter 18 Jahren empfohlen.
Antivirale Aktivität
Entecavir wird zum Triphosphat phosphoryliert und hemmt dann kompetitiv die Funktion der viralen Polymerase. Es blockiert die reverse Transkription des negativen DNA-Strangs aus der prägenomischen mRNA und die Synthese des positiven Strangs der HBV-DNA. Die intrazelluläre Halbwertzeit des Triphosphats beträgt etwa 15 Stunden. Entecavir ist in vitro deutlich aktiver als Lamivudin. Es hemmt die Synthese der HBV-DNA in HepG2-Zellen bereits bei einer Konzentration von 4 nM (EC50, 50% Reduktion), während für den gleichen Effekt 116 nM Lamivudin notwendig waren. [3] Dement-sprechend niedrig sind die empfohlenen Dosierungen des neuen Arzneimittels: es sind nur 0,5 bis 1,0 mg einmal täglich erforderlich.
Pharmakokinetische Eigenschaften
Entecavir wird schnell resorbiert, die Spitzenkonzentration im Plasma tritt nach etwa einer Stunde auf. Die Bioverfügbarkeit liegt bei mindestens 70 %. Ein „Steady-state“ wird zwischen sechs und zehn Tagen nach einmal täglicher Gabe erreicht. Die Spitzenkonzentrationen und Talspiegel im Steady-state wurden für eine Dosis von 0,5 mg mit 4,2 bzw. 0,3 ng/ml ermittelt. Die Gabe von 0,5 mg Entecavir zusammen mit einer Mahlzeit resultierte in einer Verringerung der Spitzen-konzentration um etwa 45% und einer Verringerung der AUC-Werte um ca. 20%. Die Proteinbindung ist niedrig (ca. 13%).[1,4]
Entecavir ist kein Substrat, Inhibitor oder Induktor des CYP450 Enzymsystems. Die Substanz wird vorwiegend über die Nieren eliminiert, wobei es zu 75% unverändert mit dem Urin ausgeschieden wird. Nach Erreichen des Spitzenwertes verringern sich die Konzentrationen im Plasma mit einer terminalen Eliminationshalbwertszeit von 128 - 149 Stunden. Die Ausscheidung von Entecavir ist reduziert bei eingeschränkter Nierenfunktion (siehe Tabelle). Bei einer Kreatinin-Clearance von 30 – 49 ml/min wird die Hälfte der sonst üblichen Dosierung empfohlen. Für Dosierungen unter 0,5 mg steht eine Lösung des Wirkstoffes zur Verfügung.
|
Kreatinin- Clearance (ml/min) |
|
|
|
|
Lamivudin-refraktäre |
|
|
> 50 |
einmal täglich 0,5 mg |
einmal täglich 1 mg |
|
30 – 49 |
0,25 mg einmal täglich ODER 0,5 mg alle 48 Stunden |
0,5 mg einmal täglich |
|
10 – 29 |
0,15 mg einmal täglich ODER 0,5 mg alle 72 Stunden |
0,3 mg einmal täglich ODER 0,5 mg alle 48 Stunden |
|
< 10 Hämodialyse oder CAPD |
0,05 mg einmal täglich ODER 0,5 mg alle 5 – 7 Tage |
0,1 mg einmal täglich ODER 0,5 mg alle 72 Stunden |
Eine Leberfunktionsstörung hatte keinen Einfluss auf die Pharmakokinetik des Arzneistoffs. Die AUC war bei Frauen 14% höher als bei Männern und bei älteren Patienten 29% höher im Vergleich zu jüngeren Patienten, in beiden Fällen resultieren diese Veränderungen wohl hauptsächlich aus der unterschiedlichen Nierenfunktion und dem geringeren Körpergewicht.
Klinische Studien
Entecavir ist indiziert zur Behandlung der chronischen Hepatitis B-Virus-Infektion (HBV) bei Erwachsenen mit kompensierter Lebererkrankung und nachgewiesener aktiver Virusreplikation, persistierend erhöhten Serumspiegeln der Alaninaminotransferase (ALT) sowie mit dem histologischen Befund einer aktiven Entzündung und/oder Fibrose. Diese Indikation basiert auf Daten aus klinischen Studien bei Patienten mit HBeAg-positiver und HBeAg-negativer HBV-Infektion, sowie Patienten mit einer Lamivudin-refraktären Hepatitis B. [5,6,7] In einer umfangreichen Doppelblindstudie wurden mehr als 600 HBeAg-positive Patienten, die nicht mit Nukleosidanaloga vorbehandelt waren („Nukleosid-naiv“), entweder mit 100 mg Lamivudin oder 0,5 mg Entecavir behandelt. Nach 48 Wochen war bei 72% der mit Entecavir und bei 62% der mit Lamivudin behandelten Patienten eine Besserung des histologischen Befundes erkennbar. Die Behandlung mit Entecavir führte bei zwei von drei Patienten zu einer Reduktion der Virusmenge im Blut unterhalb der Nachweisgrenze, eine entsprechende Wirkung war mit dem Vergleichspräparat nur bei 36% der Studienteilnehmer nachweisbar. Diese Unterschiede zwischen den Gruppen waren statistisch signifikant. [3]
Eine HBeAg-negative Hepatitis besteht als Folge von Virusmutanten im Bereich des Core-Gens (z. B. HBV-Präcore- oder Core-Promotor-Mutanten), welche die Bildung von HBeAg verhindern. Der Leberschaden ist in diesen Fällen meist stärker ausgeprägt. In einer sehr ähnlich konzipierten Doppelblindstudie wurden auch bei diesen Patienten mit Entecavir signifikant bessere Therapieergebnisse erzielt als mit Lamivudin. Resistente Virusmutanten wurden bei den mit Entecavir behandelten Patienten in beiden Studien nicht isoliert, in der Lamivudin-Gruppe zeigte sich die bekannte, relativ rasche Resistenzentwicklung der Viren. Innerhalb eines Jahres wurde bei 8% der mit Lamivudin behandelten Patienten ein Versagen der Virussuppression festgestellt. In der Mehrzahl dieser Fälle (80%) lag eine Mutation im HBV Polymerase-Gen im YMDD-Bereich vor (YMDD = Tyrosin, Methionin, Aspartat, Aspartat). [4] In einer weiteren klinischen Studie wurde die Wirksamkeit und Verträglichkeit von Entecavir in einer höheren Dosierung von täglich 1 mg bei Lamivudin-refraktären Patienten untersucht. Auch in diesen Fällen erwies sich Entecavir als wirksam, eine Verbesserung des Krankheitsverlaufes wurde bei der Mehrzahl der Patienten histologisch nachgewiesen. [1] Erste Erfahrungen bestehen auch bei Patienten mit einer Resistenz der Viren gegen Adefovir. In diesen Fällen ist die Aminosäure Valin gegen Isoleucin in Position 233 des viralen Enzyms ersetzt. In oben genannten Studien wiesen die Viren von insgesamt acht Patienten diese Mutation auf. Alle Patienten sprachen auf die Behandlung mit Entecavir an. [6]
Verträglichkeit
Die Beurteilung der Nebenwirkungen basiert auf vier klinischen Studien mit insgesamt 1.720 Patienten mit chronischer Hepatitis B-Infektion, die in einem doppelblinden Therapieschema entweder 0,5 mg Entecavir pro Tag (n = 679), 1 mg Entecavir pro Tag (n = 183) oder Lamivudin (n = 858) für bis zu 107 Wochen erhielten. [1] Die Sicherheitsprofile von Entecavir und Lamivudin, einschließlich Laborwert-abweichungen, waren in diesen Studien ähnlich. Die häufigsten Nebenwirkungen mit einem möglichen oder wahrscheinlichen Zusammenhang mit Entecavir, waren Kopfschmerzen (9%), Müdigkeit (6%), Schwindel (4%) und Übelkeit (3%). Entecavir besitzt nach den bisherigen Erfahrungen also eine gute Verträglichkeit. Auch eine fortgesetzte Behandlung über eine mediane Dauer von 96 Wochen erbrachte keine neuen Sicherheitsaspekte.
ZUSAMMENFASSUNG
Entecavir (BARACLUDE) ist ein Nukleosidanalogon zur Behandlung der chronischen Hepatitis B. In vitro weist es eine höhere
Aktivität als Lamivudin (EPIVIR) auf, die pharmakokinetischen Eigenschaften gestatten eine einmal tägliche orale Gabe. In umfangreichen Doppelblindstudien war es bei etwa gleicher Verträglichkeit
besser wirksam als Lamivudin. Die Wirksamkeit erstreckte sich gegen Viren, die gegen Lamivudin oder Adefovir (HEPSERA) resistent waren. Insgesamt stellt Entecavir eine wesentliche Verbesserung der
therapeutischen Möglichkeiten der chronischen Hepatitis B dar. Da eine Eradikation der Erreger nicht erfolgt, ist eine Heilung der Erkrankung allerdings auch mit diesem Arzneimittel nicht
möglich.
1. INNAIMO, S. F. et al. Identification of
BMS-200475 as a potent and selective inhibitor of hepatitis B virus.
Antimicrob Agents Chemother 1997; 41: 1444 – 1448
2. OSBORN, M. K., LOK, A.S.F. Antiviral options for the treatment of chronic hepatitis B.
J Antimicrob Chemother 2006; 57: 1030 –
1034
3. CHANG, T.-T. et al
A comparison of entecavir and
lamivudine for HBeAg-positive chronic hepatitis B.
N Engl J Med 2006; 354: 1001 –
1010
4. LAI, C.-L. et al. Entecavir
versus lamivudine for patients with HBeAg-negative chronic hepatitis B.
N Engl J Med 2006; 354: 1011 –
1020
5. HOOFNAGLE, J. H. Hepatitis
B--preventable and now treatable.
N Engl J Med 2006; 354: 1074 -
1076
6. CHANG, T.T., LAI, C.-L.
Hepatitis B virus with primary resistance to adefovir.
N Engl J Med 2006;
355:322-323
Ergänzungen (September 2007)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 5,
2006) sind zahlreiche weitere Arbeiten über Entecavir publiziert worden. Insbesondere soll an dieser Stelle auf die folgende Arbeit hingewiesen werden:
ROBINSON DM,
SCOTT LJ et al. Entecavir: a review of its use
in chronic hepatitis B. Drugs. 2006;66(12):1605-22; discussion 1623-4.
Seit der Einführung von Entecavir zur Therapie der chronischen Hepatitis B sind weitere Arzneimittel für diese Indikation auf den Markt
gekommen.