COMIRNATY – der erste COVID-19-Impfstoff mit regulärer FDA-Zulassung
Unveränderter Text aus Heft 5, 2021
Sehr rasch nach der Entdeckung des Coronavirus SARS-CoV-2 als Verursacher der Pandemie begann weltweit die Entwicklung von COVID-19-Impfstoffen. Die intensiven Bemühungen führten unerwartet schnell zum Erfolg - nie zuvor sind Vakzine in derart kurzer Zeit entwickelt worden. Die Phasen der klinischen Studien wurden überlappend begonnen und die behördliche Prüfung fand als „rolling review“ parallel zu den klinischen Studien statt. Außerdem begann die Impfstoffproduktion bereits vor der Zulassung. Die klinische Prüfung hatte dagegen das übliche Sicherheitsniveau: An den Placebo-kontrollierten Wirksamkeitsstudien nahmen mehrere 10.000 Personen teil.1 Nach Angaben der WHO befanden sich Mitte 2021 gut 100 Impfstoffe in der klinischen Prüfung, mehr als 180 durchlaufen präklinische Untersuchungen.2 COMIRNATY (= Tozinameran, BNT162b2), der Impfstoff von BioNTech / Pfizer, erhielt bereits im Dezember 2020 in den USA eine Notfallzulassung von der FDA, Ende August 2021 erfolgte eine reguläre Zulassung in den USA. Eine bedingte Zulassung wurde von der europäischen Behörde EMA ebenfalls im Dezember 2020 erteilt, damit ist die Zulassung zunächst für ein Jahr begrenzt. Der erfolgreiche Start des Impfstoffs ist umso bemerkenswerter, weil erstmals ein Vakzin auf mRNA-Basis entwickelt wurde.
mRNA kodiert für das Spikeprotein
Die Immunabwehr wird vor allem durch die Proteine des Virus aktiviert. Dabei ist besonders das S-(„spike“)-Glykoprotein von Interesse, da es an den ACE2-Rezeptor andockt und sich über diesen Weg Zugang zum menschlichen Körper verschafft. COMIRNATY enthält mRNA, die für das trimere S-Protein kodiert. Die Ribonukleinsäure wurde modifiziert, sie kodiert für membranverankertes S-Protein in voller Länge mit zwei Punktmutationen innerhalb der zentralen Helix. Die Mutation dieser beiden Aminosäuren zu Prolin fixiert das S-Protein in einer antigenetisch bevorzugten Prä-Fusionskonformation, die als S-2P bezeichnet wird. Dieses modifizierte, virale Protein wird von den menschlichen Zellen hergestellt, wenn die RNA im Zytoplasma abgelesen wird. Der Impfstoff löst sowohl neutralisierende Antikörper als auch zelluläre Immunantworten gegen das Spike-Antigen aus.
Lipidzubereitung
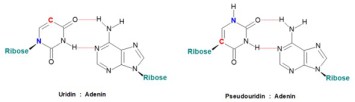
mRNA ist negativ geladen und hydrophil, sie kann Zellmembranen nicht überwinden. Durch eine Formulierung in Lipidnanopartikeln wird es möglich, die mRNA in Wirtszellen einzubringen, um die transiente Expression des SARS-CoV-2 Spike-Antigens zu steuern. Die mRNA muss außerdem stabilisiert werden, damit sie nicht durch RNAsen abgebaut wird. Bei der Mainzer Firma BioNTech wurden mehrere Impfstoffkandidaten auf der Basis der mRNA-Technologie mit modifizierten Nukleosiden in Lipidnanopartikeln entwickelt. Durch den Austausch von Uridin gegen 1-Methylpseudouridin wird die Aktivierung des unspezifischen Immunsystems über TLRs (toll-like receptors) reduziert. Dadurch kann die Impfreaktion (Fieber, Schüttelfrost, Abgeschlagenheit etc.) abgemildert und die RNA-Menge erhöht werden, was wiederum zur Präsentation von mehr Antigen und einer besseren Impfantwort führt.4 Am 5´-Ende der RNA wird ein modifiziertes Guanin-Nukleosid als Cap-Struktur angefügt, das 3´-Ende trägt einen poly-(A)-Rest, was den physiologischen Vorgängen bei der zellulären RNA-Synthese entspricht.
Abbildung: Durch den Ersatz von Uridin durch Pseudouridin bzw. 1-Methylpseudouridin wird die Translation verbessert. In beiden Fällen erfolgt eine Paarung über Wasserstoffbrücken mit Adenin (mod. nach Kariko et al., 2008).
Klinische Studien
Die hohe Schutzwirkung des Impfstoffkandidaten BNT162b2 wurde in einer umfangreichen Studie nachgewiesen.5,6 Insgesamt nahmen 43.548 Personen teil. Sie waren zwischen 16 und 91 Jahre alt (Median: 52 Jahre), jeder dritte war übergewichtig mit einem BMI ≥30. In der Verumgruppe erkrankten nur neun und damit deutlich weniger als in der Placebogruppe, in der 171 Teilnehmer eine symptomatische Infektion entwickelten. Deutlich ist auch der Unterschied bei den schwer Erkrankten. Neun Patienten in der Placebogruppe stand nur ein Fall in der Impfstoffgruppe gegenüber. Aus den Zahlen lässt sich eine hohe Schutzwirkung von 95% ableiten.
Unerwünschte Wirkungen
Die häufigsten unerwünschten Wirkungen waren vorübergehende, leichte bis moderate Schmerzen an der Injektionsstelle, sowie Schwächegefühl und Kopfschmerzen. Offenbar waren die in der Studie registrierten unerwünschten Ereignisse nicht immer Impfstoff-bedingt, wie ein Beispiel deutlich machen soll: Kopfschmerzen traten in der Placebogruppe nach der ersten Injektion bei 34% der Teilnehmer auf (42% in der Impfstoffgruppe). Diese Häufigkeitsangaben stammen aus der Gruppe der 16- bis 55-Jährigen nach der ersten Dosis. Die Inzidenzen waren in beiden Gruppen bei den über 55-Jährigen niedriger (18% vs. 25%). In beiden Altersgruppen traten Kopfschmerzen jedoch nach der zweiten Impfung häufiger auf. Kopfschmerzen und andere Nebenwirkungen sind nicht unerwartet, denn sie sind Zeichen der immunologischen Reaktion und entsprechen etwa denen von anderen Vakzinen.
In einem Rote-Hand-Brief wird auf sehr seltene Fälle von Myokarditis und Perikarditis in Verbindung mit diesen Impfstoffen hingewiesen. Die Fälle traten primär innerhalb von 14 Tagen nach der Impfung auf, und zwar häufiger nach der zweiten Dosis und bei jüngeren Männern (siehe Artikel zu Myokarditis nach mRNA-Impfstoffen im Heft 5, 2021).
Der Impfstoff ist kontraindiziert bei Personen, die zuvor schwere allergische Reaktionen (Anaphylaxie) auf andere Impfstoffe, Arzneimittel oder Nahrungsmittel erlitten haben. Treten nach der ersten Impfung allergische Reaktionen auf, darf die zweite Injektion nicht erfolgen.
COMIRNATY muss bei minus 70º C gelagert werden. Das ungeöffnete Behältnis ist bei Kühlschranktemperatur (2º C bis 8º C) nur begrenzte Zeit stabil. Während der Zeitraum zunächst auf fünf Tage begrenzt war, wurde er aufgrund neuerer Untersuchungen auf 31 Tage verlängert. Dadurch werden die logistischen Herausforderungen erheblich reduziert.
ZUSAMMENFASSUNG:
COMIRNATY (= Tozinameran, BNT162b2) ist der erste Impfstoff gegen COVID-19, der in den USA regulär zugelassen wurde, nachdem die FDA zunächst eine zeitlich begrenzte emergency use authorisation erteilt hatte. In Europa besteht derzeit noch eine bedingte Zulassung (conditional approval), die nach 12 Monaten erneut überprüft wird. Der Impfstoff enthält pro Dosis eine Lipidnanopartikelzubereitung mit 30 µg mRNA, die für das virale Spikeprotein kodiert. Nach intramuskulärer Injektion wird in den Muskelzellen das Spikeprotein synthetisiert. Damit ist eine spezifische Reaktion des Immunsystems verbunden. In umfangreichen, Placebo-kontrollierten Studien konnte eine Wirksamkeit von mehr als 90% ermittelt werden. Die Verträglichkeit ist insgesamt gut, die häufigsten unerwünschten Wirkungen sind Symptome der immunologischen Reaktion und entsprechen den Reaktionen nach anderen Impfstoffen.
Literatur
1. Krammer F. SARS-CoV-2 vaccines in development. Nature. 2020 Oct;586(7830):516-527. doi: 10.1038/s41586-020-2798-3. Epub 2020 Sep 23. PMID:32967006
2. WHO. Draft landscape of COVID-19 candidate vaccines. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
3. Lamb YN. BNT162b2 mRNA COVID-19 vaccine: First Approval. Drugs 2021 (online, 08 March 2021)
4. Karikó K, Muramatsu H, Welsh FA, Ludwig J, Kato H, Akira S, Weissman D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther. 2008 Nov;16(11):1833-40. doi: 10.1038/mt.2008.200. Epub 2008 Sep 16. PMID: 18797453; PMCID: PMC2775451.
5. EMA 2020. Comirnaty product information as approved by the CHMP on December 21, 2020, pending endorsement by the European Commission https://www.ema.europa.eu/documents/product-information/comirnaty-product-information-approved-chmp-21-december-2020-pending-endorsement-european-commission_en.pdf
6. Polack FP et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246