Telbivudin – ein Nukleosid-Analogon zur Behandlung der chronischen Hepatitis B
(Unveränderter Text aus Heft 4, 2007)
Aktuelle Ergänzungen am Ende des Textes
Lange Zeit galt es als
schwierig, Arzneimittel zur Behandlung von Virusinfektionen zu entwickeln. Die viralen Prozesse und die Funktionen der Wirtszellen galten als zu eng verzahnt, als dass es gelingen könnte, die
Virusvermehrung zu stoppen, ohne den Zellstoffwechsel des Wirtsorganismus zu stören. Diese Ansichten sind heute überholt. Seit einigen Jahren werden kontinuierlich neue Substanzen zur antiviralen
Therapie entwickelt, die eine rationale Behandlung von Virusinfektionen möglich machen. Derzeit stehen zum Beispiel zur Behandlung der chronischen Hepatitis B die folgenden Arzneimittel zur
Verfügung: Lamivudin (ZEFFIX),
Adefovir (HEPSERA) und Entecavir (BARACLUDE). Mit Telbivudin (SEBIVO) ist vor einigen
Wochen ein weiteres Nukleosid-Analogon für diese Indikation hinzugekommen.1,2
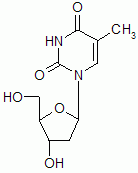
Strukturformel von Telbivudin (L-Enantiomer von Thymidin)
Chemische Struktur, antivirale Aktivität
Im Vergleich zu dem natürlich vorkommenden Nukleosid besteht bei diesem Analogon nur eine besonders geringe chemische Modifikation: Telbivudin stellt das
L-Enantiomer von Thymidin dar. Der Arzneistoff wird durch zelluläre Kinasen in das biologisch aktive Triphosphat umgewandelt, das eine intrazelluläre Halbwertzeit von etwa 14 Stunden besitzt. Das
Triphosphat hemmt die DNA-Polymerase („reverse Transkriptase“) der Hepatitis B Viren durch kompetitiven Antagonismus. Darüber hinaus führt der Einbau des Telbivudin-Triphosphats in die virale DNA zum
Kettenabbruch, wodurch die virale Replikation gehemmt wird. Dieses erfolgt bereits in niedrigen Konzentrationen, bei denen die zellulären DNA-Polymerasen nicht gehemmt werden. In einer
Hepatom-Zelllinie zeigte sich in vitro bereits bei einer Konzentration (EC50) von etwa 0,2 µM (= 0,05 mg/l) eine Hemmung der Virussynthese. Telbivudin ist nicht wirksam gegen HIV.
Pharmakokinetische Eigenschaften
Die Resorption von Telbivudin aus dem Magendarmtrakt ist gut und wird durch Nahrung nicht beeinflusst. Nach einer Einzeldosis von 600 mg lag der Spitzenspiegel im Plasma bei 3,2 mg/l, ein AUC-Wert
von 28 mg/l x h wurde berechnet. Der Wirkstoff ist nur in geringem Maße an Plasmaproteine gebunden (ca. 3%). Die Konzentration im Plasma nimmt mit einer terminalen Halbwertzeit von ca. 40 Stunden
biexponentiell ab. Telbivudin wird unverändert renal überwiegend durch glomeruläre Filtration eliminiert. Bei einmal täglicher Einnahme wird ein „steady-state“ nach 5 bis 7 Tagen erreicht, die
Talspiegel liegen dann zwischen 0,2 bis 0,3 mg/l.1,3
Da die Clearance bei eingeschränkter Nierenfunktion reduziert ist, muss die Dosierung entsprechend angepasst werden. Im Vergleich zu Probanden mit normaler Nierenfunktion (ClCr > 80
ml/min), lag die Telbivudin-Clearance bei Patienten mit eingeschränkter Nierenfunktion (ClCr 30 – 49 ml/min) bei 43 anstatt bei 126 ml/min. Die folgende Veränderung des
Dosierungsintervalls wird daher bei Patienten mit Niereninsuffizienz empfohlen:
|
Nierenfunktion (ClCr)
|
Dosis (mg) |
Dosierungs- intervall (h) |
|
> 50
|
600 |
24 |
|
30 - 49
|
600 |
48 |
|
<30
|
600 |
72 |
|
terminale NI
|
600 |
96 |
* nicht dialysepflichtig
** terminale Niereninsuffizienz
Aufgrund der bisher vorliegenden Daten ist bei Patienten mit eingeschränkter Leberfunktion keine Anpassung der Dosierung notwendig.
Klinische Studien
In einer umfangreichen Doppelblindstudie („GLOBE“) wurden die klinische Wirksamkeit und die Verträglichkeit des Arzneimittels in einer Dosierung von 600 mg täglich oral an insgesamt 1376 Patienten
überprüft. Zum Vergleich wurden in dieser Phase-III-Studie die Patienten mit Lamivudin (100 mg täglich) behandelt. Die meisten Patienten waren Asiaten, die Studie wurde über einen Zeitraum von 104
Wochen durchgeführt. Der primäre Endpunkt, an dem der therapeutische Erfolg gemessen wurde, war wie folgt definiert: eine Suppression der HBV-DNA auf weniger als 105 Kopien / ml Blut und
gleichzeitige Normalisierung der Transaminasen (GPT) oder HbeAg-Verlust im Serum.4
Telbivudin war in dieser umfangreichen Studie dem Vergleichspräparat überlegen. Bei HBeAg-positiven Patienten lag nach 52 Wochen die therapeutische Ansprechrate bei 75,3% im Vergleich zu 67% der
Patienten in der Lamivudin-Gruppe. Nach 2 Jahren betrugen die entsprechenden Zahlen 64% und 48%. Auch bei den HBeAg-negativen Patienten ergab sich ein Vorteil für Telbivudin (78% vs. 66%). Darüber
hinaus ist es bemerkenswert, dass bei der Behandlung mit Telbivudin signifikant weniger Resistenzen auftraten als in der Vergleichsgruppe (HBeAg-positive Patienten: 17,8% vs. 30,1%, HBeAg-negative
Patienten: 7,3% vs. 16,6%).
In einer weiteren klinischen Studie wurden Telbivudin und Adefovir miteinander verglichen. Dabei wurden auch die Folgen einer Umstellung von Adefovir auf Telbivudin untersucht. Auch in dieser Studie
waren Vorteile für Telbivudin erkennbar. Die Viruslast war signifikant niedriger als unter Adefovir; jene Patienten, die zunächst Adefovir erhalten hatten, erreichten bei einer Umstellung nach 24
Wochen innerhalb kurzer Zeit vergleichbare Werte, wie jene Patienten, die von Beginn an mit Telbivudin behandelt worden waren.5
Verträglichkeit
Telbivudin erwies sich in der klinischen Prüfung als insgesamt gut verträglich. Bei 7,5% der Patienten wurde jedoch ein Anstieg der Kreatinkinase (CK) festgestellt (Vergleichsgruppe: 3,1%),
gelegentlich kam es zu Myalgien und Myopathien. Die Veränderungen der CK waren meist asymptomatisch und trotz fortgesetzter Therapie reversibel. Erhöhte Ausgangswerte dieses Laborparameters und eine
kaukasische Abstammung wurden als prädiktive Faktoren für diese Veränderung identifiziert. Beim Auftreten einer Myopathie muss die Telbivudin-Behandlung abgebrochen werden. Besondere Vorsicht scheint
geboten, wenn gleichzeitig weitere Arzneimittel angewandt werden, die eine Myopathie verursachen können [Statine, Fibrate, Cyclosporin (SANDIMMUN) u.a.]. Als weitere unerwünschte Symptome, die mit
der Telbivudin-Therapie assoziiert waren, werden Hautausschlag, sowie Schwindel, Kopfschmerzen und Müdigkeit genannt.1,4
ZUSAMMENFASSUNG
Mit Telbivudin (SEBIVO) steht ein weiteres Nukleosid-Analogon zur Therapie der chronischen Hepatitis B zur Verfügung. Es handelt sich um das L-Enantiomer des natürlich vorkommenden Thymidins. In
vitro besteht eine hohe Aktivität gegen HBV, gegen HIV ist die Substanz nicht wirksam. Das Virustatikum wird nach oraler Gabe gut resorbiert und unverändert renal ausgeschieden. In klinischen
Studien war es in einer einmal täglichen Dosierung von 600 mg sowohl dem Lamivudin (ZEFFIX) als auch dem Adefovir (HEPSERA) überlegen. Es ist gut verträglich, verursacht jedoch häufig einen Anstieg
der Kreatinkinase; gelegentlich kommt es zu Myopathien, die einen Therapieabbruch erforderlich machen können. Da die Substanz überwiegend an Asiaten geprüft wurde, bestehen hinsichtlich Wirksamkeit
und Verträglichkeit bei der Behandlung von Europäern oder Patienten anderer Herkunft noch gewisse Unsicherheiten. Insgesamt muss das Arzneimittel jedoch als wichtige Ergänzung der therapeutischen
Möglichkeiten bei einer chronischen Virusinfektion angesehen werden, die vor einigen Jahren noch nicht spezifisch behandelt werden konnte.
1. Fachinformation SEBIVO 600 mg Filmtabletten
Novartis Pharma, April 2007
2. KIM
JW, PARK SH et al.
Telbivudine: a novel nucleoside analog for chronic hepatitis B. Ann
Pharmacother. 2006;40:472-8
3. ZHOU
XJ, LIM SG et al.
Pharmacokinetics of telbivudine following oral administration of escalating single
and multiple doses in patients with chronic hepatitis B virus infection: pharmacodynamic implications.
Antimicrob Agents Chemother. 2006;50:874-9.
4. LAI, C.L. et al. Hepatology 2006; 44: 222A #91
5. BZOWEJ, N. et al. Hepatology 2006; 44: 563A
Ergänzungen (Januar 2008)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für
Chemotherapie (Heft 4, 2007) sind zahlreiche weitere Arbeiten über Telbivudin publiziert worden. Insbesondere soll an dieser Stelle auf die folgende Arbeit hingewiesen werden:
1. LAI
CL, GANE E et al. Telbivudine versus lamivudine in patients with chronic hepatitis B. N Engl J Med. 2007;357:2576-88.