Brivudin - eine lang bekannte Substanz mit neuer Indikation
Ergänzungen am Ende des Textes
Brivudin (ZOSTEX) ist kein neues Virustatikum, aber es ist für eine neue Indikation zugelassen. Das Nukleosidanalogon wurde bereits in den siebziger Jahren in der damaligen DDR und in England synthetisiert. Während es bis zum Jahr 2000 unter dem Handelsnamen HELPIN zur Therapie von Herpes simplex-Infektionen angeboten wurde, steht es seit 2001 zur Behandlung eines Herpes zoster bei immunkompetenten Erwachsenen unter dem Handelsnamen ZOSTEX zur Verfügung. Die Empfehlung zur Häufigkeit der täglichen Einnahme wurde gleichzeitig mit der Indikationsänderung von viermal täglich auf einmal täglich reduziert.
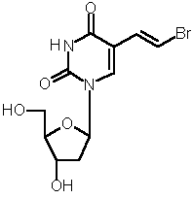
Strukturformel von Brivudin, einem Thymidinanalogon. Im Gegensatz zu anderen Nukleosidanaloga ist die Base verändert, nicht der Zuckeranteil. Durch Abspaltung der Desoxyribose erfolgt der Abbau zu Bromvinyluracil (BVU).
Antivirale Wirkung
Ähnlich wie Aciclovir (ZOVIRAX u.a.) oder andere Nukleoside muss die Substanz erst zum Triphosphat umgewandelt werden, bevor es durch Hemmung der
DNA-Polymerase seine Hemmwirkung gegen Herpesviren entfalten kann. Da die Phosphorylierung vor allem in virusinfizierten Zellen abläuft, werden diese Zellen bevorzugt betroffen. Im direkten Vergleich
mit den anderen Virustatika, die zur Zostertherapie angeboten werden, besitzt es in vitro eine mehr als 100fach höhere antivirale Aktivität als Aciclovir oder Penciclovir/Famciclovir (FAMVIR). Bereits niedrige
Konzentrationen im Bereich von 0,001 mg/l reichen zur Hemmung des Varizella-Zoster-Virus aus.
Pharmakokinetische Eigenschaften
Nach oraler Einnahme unterliegt die Substanz einem erheblichen „first-pass-Effekt“ – die Bioverfügbarkeit liegt daher nur bei etwa 30%. Eine Stunde nach Einnahme einer Dosis von 125 mg werden im
Plasma mittlere Konzentrationen von etwa 1,7 mg/l gemessen – die Konzentrationen liegen also um ein Vielfaches über den in vitro erforderlichen Konzentrationen zur Hemmung der Viren. Die Resorption
wird durch gleichzeitige Nahrungsaufnahme zwar verzögert, aber insgesamt nicht beeinflusst. Der Wirkstoff wird zu >95% an Plasmaproteine gebunden, das Verteilungsvolumen wird mit 75 Litern
angegeben. Brivudin wird durch das Enzym Pyrimidinphosphorylase, welches die Zuckerkomponente abspaltet, zu Bromvinyluracil (BVU), einem Metaboliten ohne virustatische Aktivität abgebaut. Nach
weiteren metabolischen Schritten wird die Substanz überwiegend in metabolisierter Form im Urin ausgeschieden, die terminale Halbwertzeit wurde mit 16 Stunden berechnet. Eine Anpassung der Dosierung
bei Patienten mit Niereninsuffizienz oder Leberinsuffizienz (Child-Pugh A-B) ist nicht erforderlich.1
Klinische Wirksamkeit
Eine siebentägige Therapie mit täglich einmal 125 mg Brivudin ist wirksam bei Herpes zoster, wenn das Präparat innerhalb von 48 (bis maximal 72) Stunden nach Beginn der Symptomatik genommen wird. Für
Brivudin wird vom Hersteller eine überlegene klinische Wirksamkeit in Anspruch genommen, die mit der hohen antiviralen Wirkung in vitro erklärt wird. Als Kriterium wird die Zeit vom Beginn der
Behandlung bis zum letztmaligen Auftreten neuer Bläschen herangezogen: in Vergleichsstudien mit Aciclovir war diese Zeitspanne von 18 Stunden auf etwa 13 bis 14 Stunden reduziert; darüber hinaus wird darauf hingewiesen, dass die
Häufigkeit der postzosterischen Neuralgie in einer Vergleichsstudie nach Behandlung mit Brivudin seltener war (33%), als nach Behandlung mit Aciclovir (43%). Die entsprechende Untersuchung wurde allerdings
nicht als ausführliche wissenschaftliche Veröffentlichung publiziert, sondern nur in Form eines Posterbeitrags, Details sind daher nicht verfügbar. Auf die generellen Limitierungen solcher
Einzelstudien wurde hingewiesen.3 Generell ist die Datenlage zu Brivudin nicht so umfangreich, wie bei den anderen Virustatika, die für die Indikation „Zoster“ angeboten werden. Dieses
Nukleosid ist international nicht so verbreitet, wie Aciclovir, Valaciclovir oder Famciclovir.
Unerwünschte Wirkungen, Risiken
Die Daten aus klinischen Studien zeigen, dass Brivudin insgesamt gut vertragen wird. Die häufigsten unerwünschten Wirkungen betrafen den Gastrointestinaltrakt. Über Übelkeit klagten etwa 2% der
Patienten, Störungen des Nervensystems (Kopfschmerzen, Schwindel etc.) waren seltener.
Bei einer Behandlung mit Brivudin kann es zu ernsthaften Komplikationen kommen, wenn eine gleichzeitige oder zeitnahe Therapie mit dem Zytostatikum 5-Fluoruracil (RIBOFLUOR u.a.) oder anderen
5-Fluorpyrimidinen erfolgt. Zwischen der Gabe dieser Medikamente muss ein zeitlicher Abstand von mindestens vier Wochen liegen, denn Brivudin hemmt das Enzym Dihydropyrimidindehydrogenase (= DPD),
welches für den Abbau physiologischer Pyrimidine und entsprechender halbsynthetischer Derivate zuständig ist. Die ausgeprägte und nachhaltige Hemmung des Enzyms erfolgt durch den Metaboliten
Bromvinyluracil (BVU) und führt zu einer Kumulation und verstärkten Toxizität von 5-Fluoruracil, die sich in erheblichen gastrointestinalen Symptomen, Neutropenie und Knochenmarkdepression äußern
kann. Bei Gabe der nahen verwandten Substanz Sorivudin (in Deutschland nicht im Handel) zusammen mit 5-Fluoruracil ist es zu Todesfällen aufgrund dieser Interaktion gekommen – dies ist in diesem
Zusammenhang von Interesse, da sowohl Brivudin als auch Sorivudin zum gleichen Metaboliten Bromvinyluracil (BVU) abgebaut werden.2
ZUSAMMENFASSUNG
Brivudin (ZOSTEX) weist in vitro eine hohe Aktivität gegen Herpesviren auf; die Substanz wird in ausreichendem Maße aus dem Gastrointestinaltrakt resorbiert. Ein Herpes zoster lässt sich durch die
einmal tägliche orale Gabe von 125 mg behandeln. Dabei ist das Virustatikum mindestens ebenso wirksam, wie Aciclovir (ZOVIRAX u.a.), Valaciclovir (VALTREX) oder Famciclovir (FAMVIR). Klinische Daten deuten sogar eine Überlegenheit im Vergleich zu den genannten Virustatika an; jedoch sind weitere
Untersuchungen notwendig, um diese Ergebnisse zu verifizieren.
1. Fachinfo Zostex, Berlin Chemie, März 2003
2. DIASIO
RB. Sorivudine and 5-fluorouracil; a clinically significant drug-drug interaction
due to inhibition of
dihydropyrimidine dehydrogenase. Br J Clin Pharmacol. 1998 Jul;46(1):1-4.
3. GROSS
G, SCHOFER H et al. Herpes zoster guideline of the German Dermatology Society
(DDG). J
Clin Virol. 2003 Apr;26(3):277-89
Ergänzung (August 2008)
Seit der Erstellung und Veröffentlichung dieses Artikels in der Zeitschrift für Chemotherapie (Heft 3, 2003) sind zahlreiche
weitere Arbeiten über Brivudin publiziert worden. Insbesondere soll an dieser Stelle auf folgende Arbeit hingewiesen werden:
DWORKIN RH,
JOHNSON RW et al. Recommendations for the management of herpes zoster. Clin Infect Dis. 2007 Jan 1;44 Suppl 1:S1-26.
Ergänzung (2018)
Herpes zoster - neue Erkenntnisse
Eine Übersicht mit dem Titel „Herpes zoster - neue Erkenntnisse zu Epidemiologie, Pathogenese, Therapie und Prävention“ finden Sie im Heft 4, 2008 dieser Zeitschrift.
Ergänzung (2018)
Impfprophylaxe des Herpes zoster
Unter dem Handelsnamen SHINGRIX ist eine Subunit-Vakzine zur Prophylaxe des Herpes zoster im Handel. Sie enthält das rekombinante Antigen E, ein wesentliches Glykoprotein des Virus und ein speziell entwickeltes Adjuvans. In Placebo-kontrollierten klinischen Studien konnte die Wirksamkeit des Impfstoffes nachgewiesen werden. Sie liegt bei über 90% und zwar in allen Altersgruppen von 50- bis zu über 80-jährigen Patienten.
Ergänzung (Mai 2020) Rote-Hand-Brief
Brivudin – neue Warnhinweise zur Vermeidung lebens-bedrohlicher Interaktionen
In einem Rote-Hand-Brief wird auf die lang bekannte, lebensbedrohliche Interaktion zwischen Brivudin und Fluoropyrimidinen erneut aufmerksam gemacht. Mehrere neue Vorsichtsmaßnahmen werden ergriffen. Unter anderem wird die Beschriftung des Umkartons überarbeitet, um noch stärker auf die Einhaltung des 4-Wochen-Intervalls zwischen der Behandlung mit Brivudin und Fluoropyrimidinen hinzuweisen. Der Mindestabstand muss eingehalten werden, da der Metabolit Bromvinyluracil (BVU) den Abbau des Zytostatikums nachhaltig hemmt (s. Beitrag im Heft 4, 2010 dieser Zeitschrift).